Стабільність білого бурякового цукру при зберіганні у залежності від його якості (частина 2)
(За матеріалами журналу «Цукровий бізнес»», №1 (7), лютий 2019 р.).
Вплив нецукрових сполук на зміну кольоровості
Дослідження колірного розподілу виявили високу ймовірність реакцій потемніння саме на поверхні кристала, адже його поверхня є більш чутливою до зовнішніх впливів, як, наприклад, температури, вологості, світла та кисню.
У дослідженні зберігання цукру не спостерігалося впливу ні світла, ні кисню. Порівняння зразків цукру з результатами досліджень зберігання та зразків цукру, кольоровість якого збільшилася під час зберігання у великому мішку та силосі, показує, що температура лише прискорює зміну кольоровості, але не є основною причиною цього процесу.
У подальших дослідженнях були проаналізовані нецукрові сполуки.
 Визначення інвертного цукру та інших моно- та олігосахаридів
Визначення інвертного цукру та інших моно- та олігосахаридів
Ймовірно, реакція Майларда та/або карамелізація є основними реакціями, що відбуваються під час зміни кольоровості. Редукуючі цукри є попередниками обох реакцій. Для підтвердження цих реакцій, важливо визначити початковий вміст моносахаридів та виявити співвідношення між можливим зниженням їх вмісту та збільшенням кольоровості. У всіх досліджених зразках із підвищеним рівнем кольоровості не вдалося виявити інвертного цукру за допомогою HPAEC (високоефективної аніонообмінної хроматографії) відповідно до методу ICUMSA 651/2/3-4, оскільки вміст був нижчим порогового значення. Так як у цілих цукрових кристалах не було виявлено інвертного цукру, оскільки відомо, що найінтенсивніше зміна кольоровості відбувається саме на поверхні кристала, було проаналізовано лише верхній його шар.
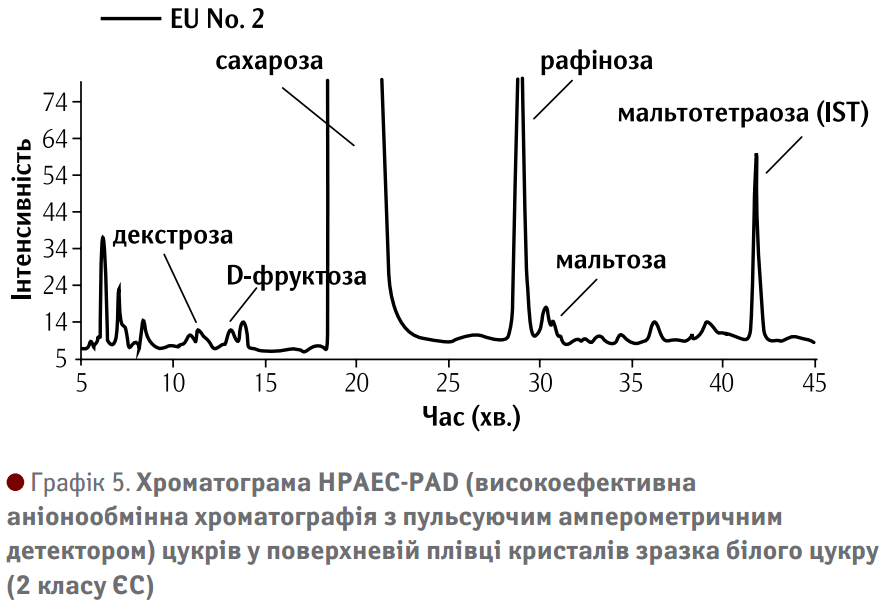
Для цього цукор змішали з 99,5% етанолу, а екстракти концентрували та аналізували за допомогою HPAEC. Як показує хроматограма на Графіку 5, окрім сахарози також було виявлено моно- та олігосахариди. Між 5 та 15 хвилинами моносахариди декстроза та D-фруктоза елюювали, а за ними слідували сахароза та олігосахариди, як, наприклад, рафіноза та мальтоза. Мальтотетраозу було додано в якості внутрішнього стандарту.
Як і очікувалося, виявилося, що поверхня кристала містить велику кількість моно- та олігосахаридів. На даному прикладі рафіноза являє собою олігосахарид із найбільшим вмістом –5-15 г/кг. У Таблиці 3 показано вміст моносахаридів декстрози та D-фруктози, а також олігосахаридів рафінози та мальтози. Для порівняння також вказано вміст моно- та олігосахаридів у сиропі. Ті ж самі сполуки також присутні в сиропі, але в різних концентраціях. Вони містяться в аналогічному порядку зростання як на поверхні кристала, так і в сиропі, що відноситься до сухої речовини та вказує на те, що поверхнева плівка кристала – це сухий сироп.
Примітно, що відносно велика кількість олігосахаридів, особливо рафінози, знаходиться на поверхні цукрового кристала. Вміст олігосахаридів збільшується за рахунок адгезії та включення у кристал під час його росту.
Таблиця 3. Вміст моно- та олігосахаридів у г/кг у поверхневому шарі кристала (зовнішній 0,1% від маси кристала) та в сиропі
| Декстроза | D-фруктоза | Рафіноза | Мальтоза | |
| 2 клас ЄС, b | 0,5 | 1,0 | 8,7 | 1,5 |
| 2 клас ЄС, d | 0,4 | 0,9 | 11,1 | 1,4 |
| Сироп | 1,1 | 1,1 | 5,1 | 0,9 |
Вміст моно- та олігосахаридів під час зберігання
Відомо, що під час карамелізації та реакції Майларда окремі сахариди більш активні, ніж олігосахариди. Сахароза може вступати у процес карамелізації або реакцію Майларда, але тільки після розщеплення на декстрозу та D-фруктозу. Гідроліз найкраще проходить при високому вмісті води і, ймовірно, не відбувається у сухих кристалах цукру. Таким чином, передбачається, що під час зберігання цукру вміст сахарози залишається незмінним. Під час зміни кольору також не можливо виявити зменшення сахарози, оскільки це зменшення є занадто низьким для його встановлення. Однак, наявні моносахариди повинні першими вступати в реакцію, так як вони більш активні.
На Графіку 6 показано хроматограму HPAEC-PAD поверхневої кристалічної плівки зразка білого цукру (2 класу ЄС, d) до та після зберігання при 55 °С протягом 6 місяців. Під час зберігання кольоровість цукру збільшилася з 16 до 26 IU, при цьому вміст моносахаридів зменшився.
Сповільнення скорочення вмісту моносахаридів вказує на зміну кольору шляхом карамелізації та/або реакції Майларда, що також пояснює інтенсивне збільшення кольоровості на початку зберігання. Зі зменшенням вмісту моносахаридів зміна кольору сповільнюється. Високий вміст інвертних цукрів у плівці міжкристального розчину викликає інтенсивнішу зміну кольору під час зберігання, що пояснює меншу зміну кольоровості цукру більш високої якості, оскільки в ньому міститься менше інвертних цукрів.
Вміст амінокислот під час зберігання
На першому етапі реакції Майларда редукуючий цукор реагує з аміносполукою, переважно з амінокислотою. Відповідно, присутність аміносполук необхідна для того, щоб відбувалася реакція Майларда. Для того щоб довести, що реакція Майларда відбувається, необхідно визначити вміст амінокислот. Опубліковано дані щодо вмісту амінокислоти у різних сиропах на різних стадіях цукрового виробництва. У даній роботі ідентифіковано та кількісно визначено 11 амінокислот у зразках білого бурякового цукру за допомогою концентрування у твердому стані, екстракції, дериватизації та аналізу з використанням газової хроматографії. На Графіку 7 показано вміст амінокислот у зразку білого цукру та в сиропі, з якого кристалізували цукор. Білий цукор 2 класу стандарту якості ЄС містить у середньому близько 10 мг/кг амінокислот, у цілому. L-Аспарагін, L-глутамінова кислота та L тирозин присутні у найбільших кількостях. Порівняно з вмістом амінокислот у сиропах під час виробництва, помітним є низький вміст L-глутаміну. Під час виробництва цукру обсяг L-глутаміну зменшується. За допомогою циклізації L-глутаміну утворюється піроглутамінова кислота. Вона може міститися у великих кількостях у сиропі та виявлена у поверхневій плівці кристала. Піроглутамінова кислота може утворювати 2-кетопірролідин шляхом декарбоксилювання, а за допомогою гідролізу 2-кетопірролідона утворюється гамма-аміномасляна кислота.
Співвідношення між окремими амінокислотами в цукрі та сиропі подібні, але у той же час їх вміст у цукрі у 700-1000 разів нижчий, ніж у сиропі. Сироп містить близько 8-10 г/кг амінокислот. Подібний ступінь накопичення усіх амінокислот свідчить про те, що амінокислоти не кристалізуються, а входять у дрібні часточки сиропу або в суху плівку міжкристального розчину. Дрібні частки сиропу та суха плівка міжкристального розчину містять ті ж самі сполуки, що і сироп, та задіяні в аналогічних реакціях, які можуть відбуватися у цукрі під час виробничого процесу.
Розподіл амінокислот у кристалах цукру
Метод афінації, який використовувався для визначення колірного розподілу, також використовувався для аналізу розподілу амінокислоти у цукрових кристалах. Вміст амінокислоти визначався у залишковому цукрі після афінації кристала, у результаті чого було виявлено, що вміст амінокислоти зменшується від поверхневого шару до центру кристала так само, як і барвник. У досліджуваних зразках цукру від 40 до 50% амінокислот знаходилися у зовнішньому шарі (0,5%) кристалічної маси. На Графіку 8 діаграма показує вміст амінокислоти у зразку білого цукру (2 класу ЄС, d) загалом та після розчинення зовнішнього шару (0,5%), 1% та 5% від загальної кристалічної маси. Загальний вміст 11 аналізованих амінокислот становить 9,9 мг/кг. Після афінації 0,5% кристалічної маси вміст амінокислоти у залишковому цукрі склав 5,9 мг/кг. Вміст усіх амінокислот демонструє однакове зменшення у напрямку до центру кристала, а їх розподіл відповідає розподілу барвника у кристалі.
Вміст амінокислот під час зберігання цукру
Наявність амінокислот і зменшення вмісту моносахаридів під час зберігання свідчить про те, що реакція Майларда відповідає за зміну кольоровості. Для підтвердження виникнення реакції Майларда визначалася зміна вмісту амінокислоти під час зберігання цукру. Вміст амінокислот визначався у зразках білого цукру до та після зберігання при 55 °С протягом 9 і 12 місяців. У всіх зразках цукру відбулися подібні зміни вмісту амінокислот. На Графіку 9 діаграма показує вміст амінокислот у цукрі 2 класу ЄС. Вміст амінокислот зменшився, тоді як кольоровість цукру збільшилася з 16 IU до 26 IU за 9 місяців та до 29 IU за 12 місяців. Перед зберіганням зразки цукру містили 9,9 мг/кг амінокислот. За 9 місяців їх обсяг зменшився до 6,5 мг/кг, а за 12 місяців — до 6,1 мг/кг. Різницю між вмістом окремих амінокислот можна пояснити їх різною реакційною здатністю у реакції Майларда. Наприклад, було виявлено найбільше зниження у вмісті гамма-аміномасляної кислоти, яка відома своєю високою реакційною здатністю до процесу зміни кольоровості під час виробництва цукру.
ВисновкиУ даному дослідженні проаналізовано вплив умов зберігання та причини зміни кольоровості під час зберігання цукру. Зміни хімічного складу нецукрових сполук під час збільшення кольоровості вказують на реакцію потемніння. Нерівномірний розподіл кольору цукру, що зберігається у великому мішку з високим показником кольоровості зовнішнього шару кристалів, підтверджує вплив вмісту води. Чим більший вміст води, тим інтенсивніше відбувається збільшення рівня кольоровості. Цукор високої якості та низької кольоровості має меншу тенденцію до зміни кольору. Тобто температурний режим та вміст води стимулюють реакцію потемніння, але не є причиною зміни кольору цукру. Отримані результати показують, що зміна кольору відбувається через наявність нецукрових сполук у цукрових кристалах. Найвищий рівень кольоровості та, відповідно, найбільший вміст нецукрових сполук виявлено у поверхневій плівці кристала. У звичайному білому буряковому цукрі до 50% барвників знаходяться у зовнішньому шарі (0,5%) кристалічної маси і, таким чином, вміст нецукрових сполук тут більший через суху плівку міжкристального розчину сиропу. Тобто під час центрифугування якість процесу промивання відіграє вирішальне значення у визначенні стабільності цукру під час зберігання. Іншою причиною високого вмісту нецукрових сполук є включення сиропу через поганий ріст кристалів, подібно до утворення агломератів. На поверхні кристала звичайного білого цукру (2 класу ЄС) кольоровість досягає 2000 IU і містить подібний вміст моно- та олігосахаридів, а також амінокислот, як і сироп. Дослідження поверхневої плівки кристала показали, що під час зберігання цукру найінтенсивніше зміна кольору у кристалі відбувається у його верхньому шарі. Це пов’язано з високим вмістом нецукрових сполук. Під час спостереження за збільшенням рівня кольоровості поверхневої плівки кристала було виявлено велику кількість органічних кислот, але вони не мають жодного відношення до збільшення кольоровості. Більшість органічних кислот, таких як янтарна, яблучна, пальмітинова та стеаринова кислота, походять із цукрових буряків. Вони не мають жодного впливу на зміну кольору, за винятком каталітичної активності. Тільки молочна кислота, яка є кількісно найважливішою кислотою, може утворюватися під час реакції Майларда або карамелізації. Під час зберігання цукру також було виявлено зниження вмісту моносахаридів та амінокислот. Це зменшення відбувається під час зміни кольору та доводить те, що реакція Maйларда відповідає за формування кольору. Під час реакції Майларда погіршення якості цукру каталізується аміносполуками. На першому етапі реакції утворюється продукт ізомеризації, який перетворюється на більш реакційно здатні α-дикарбонільні сполуки. Ці сполуки можуть змінюватися шляхом гідролізу, конденсації, окислення та елімінації на активні коротколанцюгові продукти розщеплення та різні гетероциклічні сполуки. Із цих прекурсорів можуть формуватися численні високомолекулярні та яскраво забарвлені меланоїдини. Зменшення вмісту амінокислот свідчить про те, що аміносполуки інтегрують в основу меланоїдин. На додаток до реакції Майларда, не можна виключати зміни кольору шляхом карамелізації, оскільки моносахариди також можуть розпадатися шляхом реакцій під час процесу карамелізації. Але в контексті наявних аміносполук реакція Майларда завжди буде переважати, відповідно до її високої швидкості розпаду через каталітичну активність амінокислот. Щоб уникнути зміни кольору цукру під час його зберігання, важливою умовою є якісна кристалізація та гарне промивання. Інша умова полягає у контролюванні процесу виробництва |
За матеріалами статті на тему «Дослідження стійкості зберігання білого бурякового цукру залежно від його якості» («Studies on the storage stability of white beet sugar depending on its qualitys») журналу «Цукрова галузь» («Sugar Industry») 143 (2018) №68.