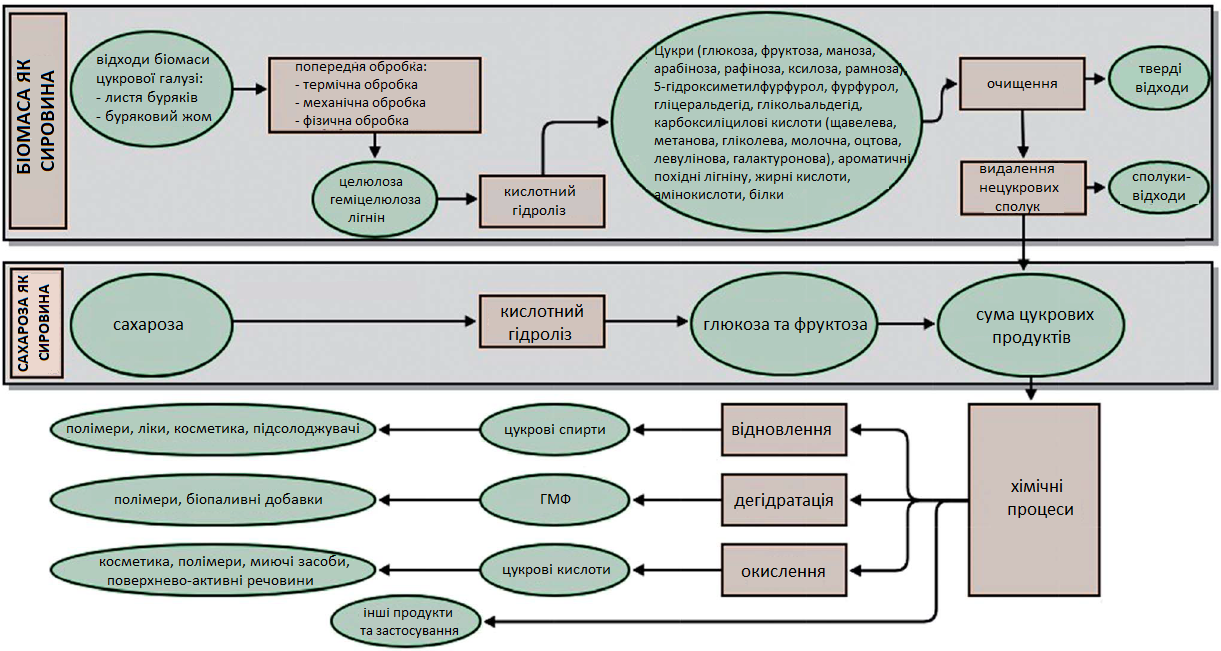
Продукти переробки цукрових буряків як сировина для виробництва хімічних речовин та біорозкладних полімерів (частина 1)

Збільшення виробництва білого цукру призводить до більшої кількості біовідходів від технологічних процесів, що вимагають розробки нових технологій використання цих відходів, на додаток до їх використання в якості корму для тварин або зеленого добрива в сільському господарстві. З огляду на поточні та прогнозовані зміни на ринку цукру, виробники цукру розглядають можливість розробки альтернативних моделей бізнесу. Це стосується не тільки спеціалістів із продажу та маркетингу, а й хіміків, біотехнологів та винахідників, які, можливо, зможуть відкрити нетрадиційні способи застосування цукру. З економічних причин цукор ніколи не розглядався як хімічна сировина. Однак у контексті падіння цін чи надлишкових потужностей у цукровій галузі його можна використовувати у виробництві цінних хімічних речовин, таких як біорозкладні полімери.
За матеріалами статті на тему «Продукти переробки цукрових буряків як сировина для хімічних речовин та біорозкладних полімерів» («Products of sugar beet processing as raw materials for chemicals and biodegradable polymers») журналу «RSC Advances» Королівського хімічного товариства (The Royal Society of Chemistry) (8) 2018 р.
ПОБІЧНІ ПРОДУКТИ, ОТРИМАНІ В ПРОЦЕСІ ВИРОБНИЦТВА ЦУКРУ
Цукор вилучається з буряків із використанням гарячої води. У результаті цього отримують дифузійний сік, який потім очищається, фільтрується і концентрується циклічним промиванням та випарюванням. Для отримання кінцевого продукту сироп проходить процес кристалізації. Потім отриманий білий цукор викристалізовується, що в кінцевому підсумку призводить до виробництва високоякісного рафінованого цукру (Рис. 1). На різних етапах переробки цукрового буряка отримуються різні продукти. Побічний продукт, який містить велику кількість води, включає в себе до 75% бурякового жому та використовується як теплове джерело і циркулюючи у закритій системі може неодноразово використовуватися для забезпечення значної частки теплових потреб лінії з виробництва цукру. Після вилучення цукру буряковий жом та стружка використовуються переважно для виробництва кормів для тварин або біогазу. Також проводяться спроби використання листя буряків у виробництві метанолу.
Після центрифугування густого сиропу (останній етап виробництва цукру) отримана патока (меляса) використовується переважно для виробництва спирту, у кормах для тварин або як середовище для виробництва дріжджової біомаси.
Цукрові продукти можна переробляти різними способами, щоб отримати не тільки цукор, але й цінні хімічні речовини, які можна використовувати у біопаливі, синтетичних матеріалах та фармацевтичних продуктах. Наприклад, завдяки високому вмісту зброджуваного цукру дифузійний сік цукрового буряка вважається непоганою сировиною для ферментації етанолу. Озонування — це ефективний спосіб стабілізації нового ферментаційного середовища, що використовується у біотехнологічному виробництві рідких паливних добавок. Отриманий таким чином етанол є відносно недорогим і може використовуватися як паливо або паливна добавка. Гідролізати цукру також розглядаються як альтернативна сировина для виробництва біорозкладної пластмаси, палива або його біокомпонентів.
Рис. 1. Спрощена схема виробництва цукру з цукрових буряків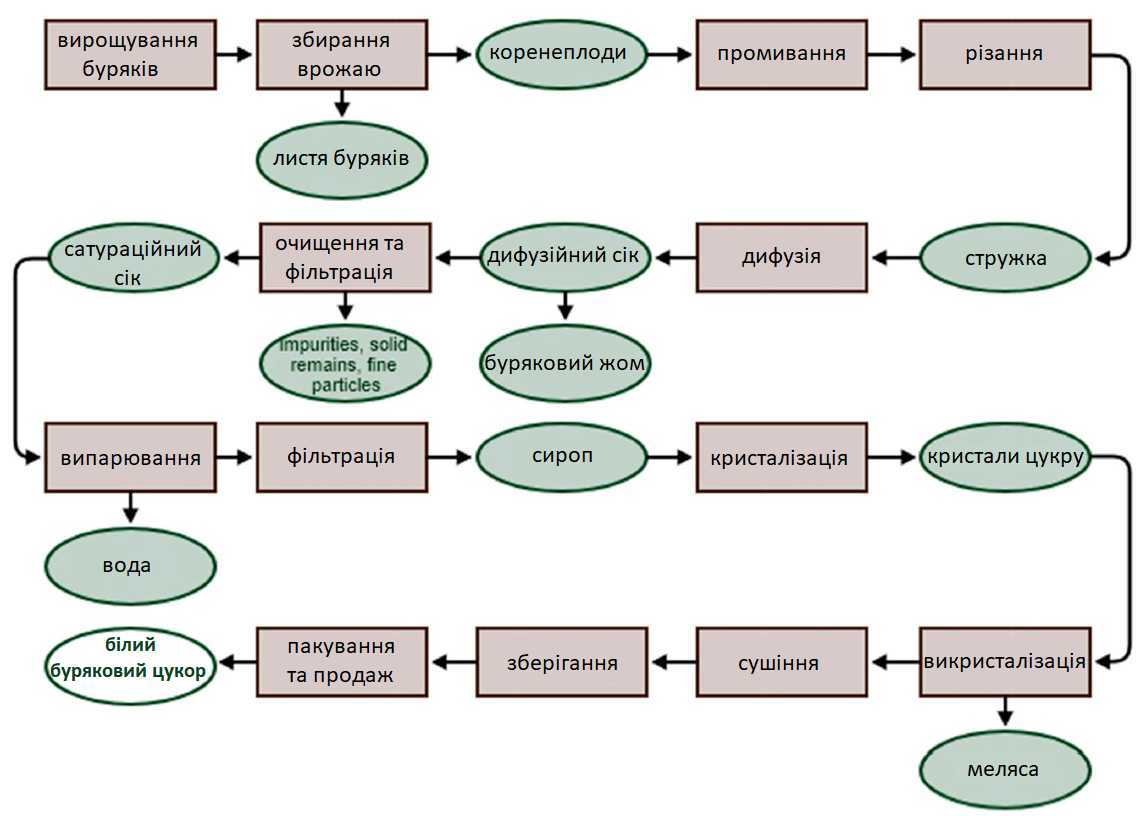
САХАРОЗА ТА ВІДХОДИ БІОМАСИ ВІД ПЕРЕРОБКИ БУРЯКІВ ЯК СИРОВИНА В БІОТЕХНОЛОГІЇ
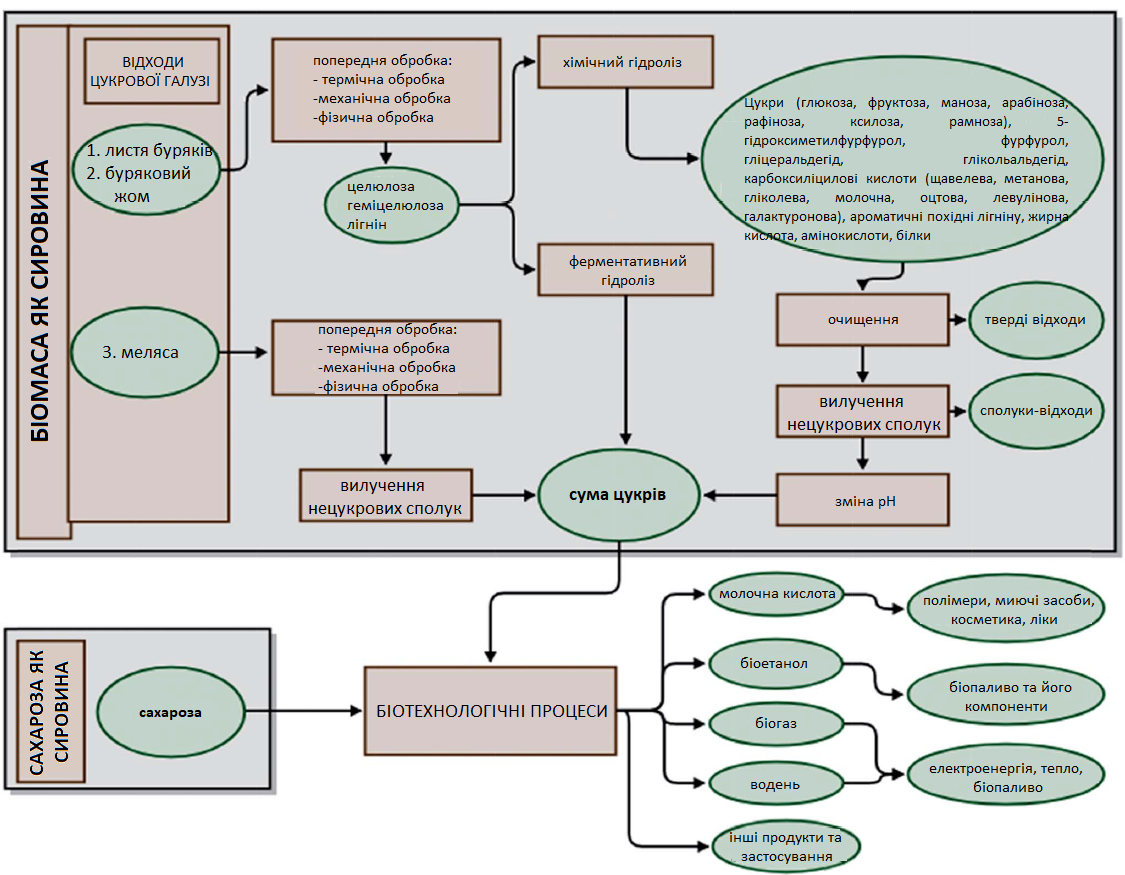
У біотехнології біомаса та сахароза зазвичай переробляються за допомогою одного з трьох методів: анаеробного дигерування, ферментації або ферментативних реакцій. Залежно від обраного методу можна виробляти біогаз (що містить переважно CH4, CO2 та N2, H2S, NH3), багатий на водень біогаз, біоетанол, біобутанол та молочну кислоту. Біотехнологічне перетворення біомаси вимагає відповідної попередньої обробки, що включає механічні, фізико-хімічні, ферментативні або хімічні стадії, для отримання суміші цукрових продуктів, які можуть служити мікробіологічним середовищем. Результатом ферментативного гідролізу є складна суміш цукрів. У випадку хімічного гідролізу до складу гідролізату також входять нецукрові продукти, які часто є інгібіторами процесу ферментації (Рис. 2). З іншого боку, використання сахарози в біотехнологічних процесах не вимагає дорогих етапів попередньої обробки (таких як подрібнення, нагрівання, обробка ультразвуком або озонування).
Перетворення сахарози також можливе безпосередньо без попередньої обробки, оскільки її отримують на цукровому заводі як чисту речовину, придатну для прямого перетворення в біотехнологічних процесах. Більше того, сахароза, яка є основним цукром у ферментованих соках, легко розщеплюється на глюкозу та фруктозу за допомогою інвертази в периплазматичному просторі мікроорганізмів на ранній стадії процесу ферментації.
Незважаючи на значний потенціал, використання сахарози як сировини в біотехнологічних процесах є економічно недоцільним. Із метою зменшення витрат замість кристалізованої сахарози можна використовувати проміжні продукти виробництва білого цукру, такі як сатураційний сік або сироп цукрових буряків. Однак їх використання в біотехнологічних процесах вимагає попереднього очищення від нецукрових сполук за допомогою озонування або адсорбції на активному вуглецю.
Рис. 2. Використання цукрів, отриманих із біомаси та кристалічної сахарози, у біохімічних процесах
Виробництво біогазу
Під час переробки однієї тонни цукрових буряків утворюється близько 70 кг сухої речовини — жому. Щорічно в ЄС під час виробництва білого цукру утворюється 14 млн т таких біовідходів. Біогаз можна виробляти шляхом анаеробного дигерування бурякового жому. Це біологічний процес, при якому за відсутності кисню органічні речовини розкладаються, як правило, шляхом витримування відповідної кількості біомаси у спеціально розробленому реакторі (ферментаційній камері) кілька днів. Вміст реактора слід підтримувати при підвищеній температурі (37-60°С), pH середовища встановити на відповідний рівень, компоненти безперервно перемішувати з оптимальною швидкістю. При цьому необхідно періодично контролювати склад біогазу. Під час анаеробного дигерування ефективність виробництва біогазу залежить від багатьох факторів, включаючи конструкцію ферментаційних камер, технологічні параметри та хімічний склад субстрату, який живить мікроорганізми, які розкладають біомасу. Швидкість виробництва біогазу обмежується насамперед розкладанням полісахаридів, що містяться у біомасі. Додатковим фактором, що знижує вихід біогазу, є наявність лігніну та кристалічної целюлози, що обмежує доступ гідролізуючих ферментів до целюлози та геміцелюлози. Враховуючи ці обмежуючі фактори, сировину необхідно піддавати різним формам попередньої обробки (термічній, тисковій та/або механічній). Це завдання складне і вимагає додаткових зусиль, витрат часу та енергії. Однак у випадку виробництва біогазу з бурякового жому вихід продукту настільки високий, що розкладання може бути економічно ефективним методом.
Виробництво водню
Водень також викликає все більший інтерес як екологічно чисте джерело енергії. Він може вироблятися багатьма біологічними організмами, включаючи зелені водорості, ціанобактерії, фотосинтезуючі та ферментативні бактерії. Останні можуть використовувати різні цукри, такі як крохмаль, целобіозу або сахарозу. Крім того, швидкість виробництва водню шляхом ферментації завжди більша, ніж під час фотосинтезу. Одним із найбільш поширених процесів, за допомогою яких мікрофлора отримує водень із сахарози, є темнова ферментація. Цей анаеробний процес розкладання органічної речовини складається з трьох основних стадій: гідролізу, метаногенезу та ацидогенезу. Під час перших двох стадій утворюються водень (основний продукт) і жирні кислоти (побічні продукти). Отримані органічні сполуки використовуються на наступній стадії для утворення метану. Водень утворюється переважно протягом перших 2 днів процесу, тоді як виробництво метану може тривати до 20 днів. Якщо в кінці кожної стадії отримують і водень, і метан, це називається двоетапною ферментацією; якщо отримують лише водень, це називається одноетапною ферментацією. Ферментацію можна проводити за різних температурних умов (від 25°С до більше 80°С) або з різною концентрацією субстрату. Однак рН є важливим фактором для досягнення високого виходу водню. Темнова ферментація може виробляти до 2,8 моль H2 із 1 моля спожитої гексози протягом 12 год. (вміст водню в отриманому біогазі знаходиться в межах 48-50%).
На жаль, біоводень поки не є конкурентоспроможним як джерело енергії , порівняно з традиційним викопним паливом. Більшість зусиль щодо зниження собівартості його виробництва, у порівнянні з викопним паливом, зосереджені на використанні відходів різних галузей промисловості як сировини. Виробництво біоводню наразі створює невеликі проблеми, але технічні аспекти (такі як відокремлення чистого водню від газової суміші) та розподіл готового палива (зберігання, транспортування) потребують подальшого вдосконалення. Якщо вдасться знайти відповідні рішення цих проблем, це може призвести до того, що альтернативні види палива стануть більш економічно вигідними.
Виробництво біоетанолу
Біоетанол є перспективним паливом, його можна виробляти з різних відновлюваних джерел. Залежно від виду сировини, що використовується, її поділяють на три покоління: перше, друге та третє. Сировина першого покоління включає кукурудзу, пшеницю, картоплю, фрукти та цукрову тростину, з яких отримують цукри, які потім ферментуються. На першому етапі ферментації такі цукри, як сахароза або крохмаль (які є основними цукрами у ферментованих соках), легко розщеплюються до моносахаридів за допомогою інвертази у мікроорганізмах — дріжджах чи бактеріях.
На жаль, попри те, що процес виробництва етанолу з цих цукрів добре відомий, він все ще майже вдвічі дорожчий, ніж виробництво бензину з сирої нафти. Дешевший біоетанол також можна виробляти безпосередньо з соків культур, що містять вільний цукор, таких як цукрова тростина, цукровий буряк або солодке сорго. Однак ці субстрати не є мікробіологічно стабільними, а ферментаційне середовище вимагає термічної стерилізації або озонування перед ферментацією. Біоетанол також може перетворюватися на більш дорогі нафтохімічні продукти, такі як бутанол та вищі гомологи, які можуть слугувати альтернативою бензину.
Виробництво сировини першого покоління займає великі сільськогосподарські площі, на яких вирощуються культури, які в іншому випадку можна було споживати в їжу. Це виробництво також потребує великої кількості води. Саме тому було розроблено біопаливо другого покоління, сировиною для виробництва якого є неспоживана лігноцелюлозна біомаса. На жаль, лігноцелюлозна біомаса переробляється не так легко, як сировина першого покоління, і вимагає багатоетапної обробки, що збільшує кінцеву вартість виробленого біоетанолу. Кожен етап — попередня обробка, гідроліз, ферментація та дистиляція — вимагає витрат енергії та видалення залишків. Для виробництва біоетанолу третього покоління використовуються мікроорганізми, особливо водорості, що обіцяє багато переваг, у порівнянні з попередніми двома поколіннями. На жаль, методи виробництво біоетанолу третього покоління все ще дуже дорогі, а їх реалізація стикається з багатьма труднощами. З цієї причини виробництво біоетанолу з використанням водоростей досліджується переважно в лабораторних масштабах.
Незалежно від виду сировини, з якої вилучаються цукри (сахароза, глюкоза, фруктоза тощо), вона може перетворюватися в біоетанол за допомогою дріжджів (таких як Saccharomyces carlsbergensis) або інших мікроорганізмів шляхом ферментації без необхідності попередньої обробки цукру. У результаті активності відповідних ферментів сахариди розщеплюються на прості цукри, які потім ферментуються та виробляють етанол. Для цього можна використовувати анаеробні бактерії, здатні перетворювати глюкозу, фруктозу та сахарозу в етанол, наприклад Zymomonas mobilis. На належне функціонування бактерій, включаючи етанол, який із них виробляється, можуть впливати багато факторів. Отриманий етанол може пригнічувати дію мікроорганізмів, тому необхідно його безперервно видаляти з системи шляхом випарювання, селективною адсорбцією або просто екстрагуючи в органічну фазу.
Значні переваги використання мікроорганізмів у біохімічних процесах включають високу селективність ферментів та м’які умови протікання реакції. Тому можна виробляти бажані продукти з надзвичайно високими показниками їх виходу. На жаль, лігнін не може легко перероблятися біохімічним чином, тому лігноцелюлозна сировина, що використовується для виробництва біоетанолу, вимагає попередньої обробки, такої як термічний, кислотний або ферментативний гідроліз. Через свою складність біохімічне перетворення лігноцелюлозної біомаси в етанол досі не є економічно вигідним, оскільки його вартість вища, ніж біоетанолу, отриманого шляхом ферментації сировини першого покоління. Тому дослідження повинні зосереджуватися на підвищенні ефективності початкової стадії розкладання, зменшенні витрат на використання ферментів та покращенні їх повторного використання. Також важливо мінімізувати витрати на попередню обробку, гідроліз та ферментацію, забезпечити безперервну роботу всього процесу.
Виробництво молочної кислоти
Інша сполука, яку можна отримати з цукрів завдяки біотехнологічним процесам, — це молочна кислота (LA). Вона використовується як підкислювач, ароматизатор або консервуючий метаболіт у багатьох галузях промисловості, включаючи харчову, фармацевтичну, шкіряну та текстильну промисловості. Ця речовина також представляє інтерес як хімічна платформа та може бути підданою численним перетворенням. Із молочної кислоти можна отримати як невеликі сполуки, такі як пропіленгліколь або акрилову кислоту, так і високомолекулярні полімери, такі як біорозкладані полімери (Рис. 3).
Рис. 3. Використання цукрів, отриманих із біомаси та кристалічної сахарози, для виробництва молочної кислоти
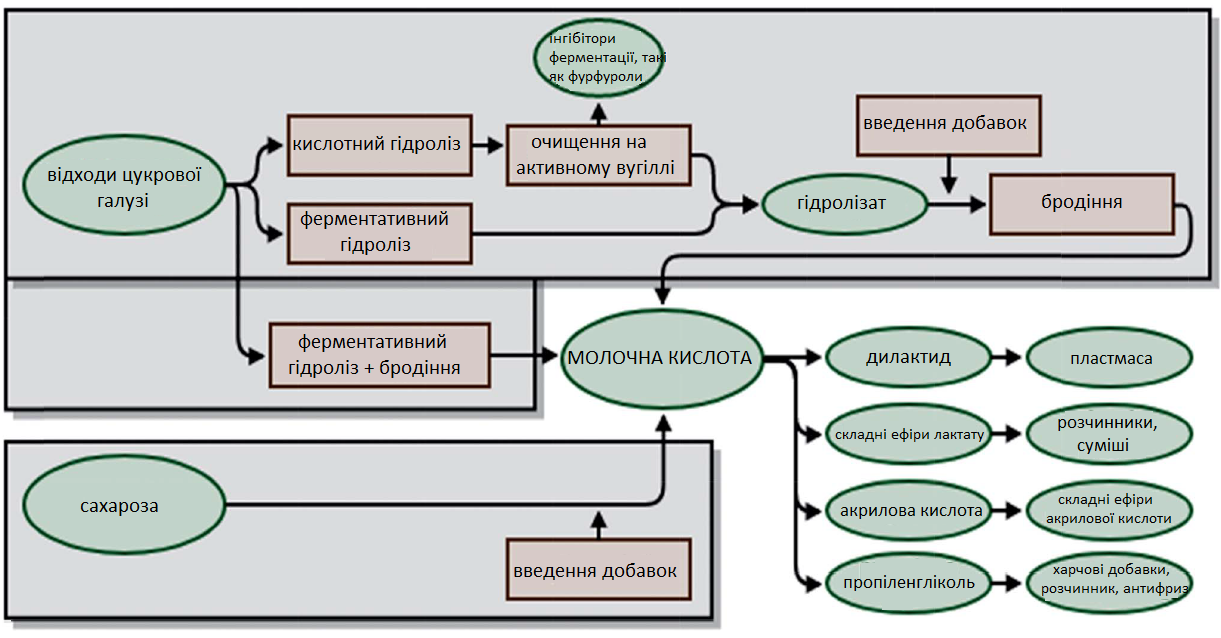
Молочна кислота виробляється в промислових масштабах шляхом ферментації сахаридів (наприклад, глюкози) з використанням молочнокислотних бактерій. Однак деякі дослідження також продемонстрували можливість виробництва молочної кислоти з побічних продуктів сільського господарства. У процесах виробництва молочної кислоти для заміни чистих цукрів використовувалася недорога сировина, така як крохмаль або меляса. Меляса — один із побічних продуктів цукрової галузі, який можна використовувати для молочнокислого бродіння. Цей субстрат, вимитий з буряків після вилучення сахарози, складається з 30-50% цукрів (переважно сахарози), а також вітамінів, азотних сполук та інших мікроелементів. Високий вміст цукрів у мелясі робить її хорошим ферментаційним середовищем для різних видів бактерій, що піддаються до молочнокислого бродіння (Таблиця 1), таких як Lactobacillus bulgaricus або Lactobacillus casei.
Таблиця 1. Меляса як сировина для виробництва молочної кислоти (LA)

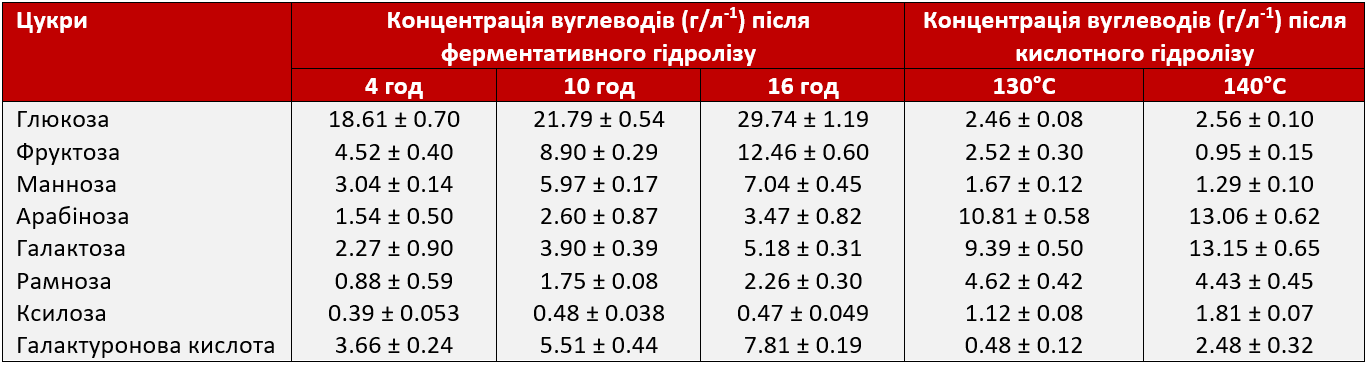
Лігноцелюлозна біомаса, така як буряковий жом, є ще одним широкодоступним побічним продуктом цукрової галузі, який розглядається як потенційне джерело цукру для молочнокислого бродіння. Суху основу бурякового жому складають переважно полісахариди, включаючи 22-24% целюлози, 30% геміцелюлози та 15-25% пектину, разом із невеликою кількістю жиру (1,4%), білка (10,3%), золи (3,7%) та лігніну (5,9%). Ферментативний або кислотний гідроліз цього побічного продукту призводить до утворення суміші моносахаридів, що складаються з глюкози, фруктози, ксилози, манози, галактози та арабіонози, а також галактуронової кислоти (Таблиця 2). Молочнокислі бактерії безпосередньо і вибірково перетворюють наявні сахариди в молочну кислоту (гомоферментативне бродіння) або виробляють побічні продукти, такі як діоксид вуглецю, оцтову кислоту, ацетальдегід та етанол (гетероферментативне бродіння). Залежно від потреби та бажаних властивостей кінцевого продукту бродіння, для ферментації цукрів необхідно відібрати відповідні штами бактерій.
Основною перевагою виробництва молочної кислоти з використанням мікроорганізмів, порівняно з хімічним виробництвом, є можливість одержання чистих кислотних стереоізомерів. У хімічному процесі завжди отримують оптично неактивну рацемічну суміш.
Вартість сировини є одним із ключових факторів, що визначають рентабельність процесів бродіння. Чиста глюкоза, сахароза та крохмаль є дорогими видами сировини для виробництва молочної кислоти. Їх заміна недорогими промисловими відходами від переробки цукру може знизити собівартість виробництва молочної кислоти. Більше того, фінансування економічного та екологічно чистого використання побічних продуктів харчової промисловості сприяє досягненню цілей сталого розвитку харчової промисловості.
Таблиця 2. Склад середовища бурякового жому під час ферментативного гідролізу (0,1 мл Viscozyme та 0,1 мл Ultraflo Max (Novozymes)/50 мл) та кислотного гідролізу (2% H2SO4)
ЦУКОР ТА ВІДХОДИ БІОМАСИ ВІД ПЕРЕРОБКИ БУРЯКІВ ЯК СИРОВИНА В ХІМІЇ
Цукрові сполуки мають різну хімічну структуру. Їх будова забезпечує синтез і трансформування за допомогою кількох реакційних груп. Цукри переробляються переважно харчовою промисловістю, але зараз їх застосування значно розширюється, в тому числі і у виробництві енергії.
Моносахариди, такі як кетози та альдози, демонструють мутацію, внаслідок чого їх циклічні форми можуть змінюватися з однієї на іншу, створюючи напівацеталі (геміацеталі). Вважається, що механізм цієї псевдореакції першого порядку відбувається шляхом утворення альдегіду. Утворення вільного альдегіду було підтверджено полярографічними дослідженнями. Процес мутаротації також став предметом теоретичних досліджень з використанням квантовомеханічних методів.
Теоретичні розрахунки показали, що розчинники сприяють мутаротації, а перша молекула діє як каталізатор, відіграючи вирішальну роль у реакції. Моносахариди можна отримати з різних відходів цукрової, сільськогосподарської та харчової галузей. Після очищення та відокремлення від зайвих сполук моносахариди можуть піддаватися різним хімічним процесам.
У багатьох випадках використання кристалічної сахарози дозволяє уникнути необхідності попередньої обробки. Сахароза, отримана на цукрових заводах, є чистою сполукою (99,9%). Як наслідок, у наступних процесах зникає необхідність видаляти інші речовини (наприклад, лігноцелюлозні сполуки) або проводити попереднє очищення. Сахароза може легко перетворюватися в моносахариди шляхом гідролізу за допомогою кислотних або гетерогенних каталізаторів (Рис. 4).
Рис. 4. Використання цукрів, отриманих із біомаси та кристалічної сахарози, у хімічних процесах
Окислення цукрів
Однією з хімічних реакцій переробки цукру є окислення. Цей процес був вдосконалений для підвищення селективності за допомогою використання відповідних каталізаторів. У результаті каталітичного окислення цукрів утворюються (серед іншого) альдонова, альдарова та уронова кислоти, які широко використовуються у харчовій, косметичній, фармацевтичній та медичній галузях промисловості. Альдонові кислоти отримуються шляхом окислення альдегідної групи, тоді як двохосновні карбонові альдарові кислоти утворюються під час одночасного окислення альдегідної групи та кінцевої гідроксильної групи. Уронові кислоти вимагають вибіркового окислення лише кінцевої гідроксильної групи, що може забезпечуватися за допомогою відповідних ферментів.
Для окислення цукрів можна використовувати гомогенні каталізатори, такі як азотну кислоту. У випадку кислотного каталізу можна використовувати різні кислоти. Із кожною кислотою реакція протікає дещо по-різному, але завжди передбачає пряму окислювальну дію на наявну карбонільну групу. У каталізованій основами реакції форма ендіолу утворюється як проміжний продукт під час окислення редукуючих цукрів. Основними перевагами цих процесів є простота, з якою каталізатор можна відокремити від реакційної суміші, та краща селективність перетворень, що призводить до меншої кількості побічних продуктів. Використання стабільних і високоселективних гетерогенних каталізаторів дозволяє проводити хімічний синтез альдонових кислот у м’яких умовах. Такі процеси є більш екологічно чистими та конкурентоспроможними, порівняно з традиційними хімічними або більш дорогими ферментативними методами.
Механізми каталітичного окислення цукрів були предметом досліджень протягом багатьох років. У якості каталізаторів використовуються благородні метали (Pt, Pd, Au, Ru) або біметалічні системи (Ag/Au, Au/Pt, Ru/Bi, Pd/Te Pd/Bi, Pd/Tl тощо). У випадку біметалічних систем додавання другого металу збільшує селективність та активність усієї каталітичної системи. Каталітичні властивості біметалічних систем залежать від структури та складу поверхні, яка у багатьох випадках відрізняється від поверхні сипучого матеріалу. Два метали можуть утворювати інтерметалічні з’єднання (наприклад, системи Pd/Bi, Pd/Tl, Pd/Te) або інтерметалічні сплави (наприклад, Pd/Ag, Pd/Au) на поверхні. Загальновідомо, що коли два метали утворюють сплав, поверхня збагачується металом, що має нижню поверхню сублімації. Багато робіт чітко показують, що інтерметалічні взаємодії в каталізаторах Pd/M відіграють важливу роль в окислювальній дегідрогенізації альдоз в альдонові кислоти.
Знання того, який тип інтерметалічної структури утворюється на поверхні, можть бути ключовими для розуміння функції металевих промоторів у цьому процесі. Азотну кислоту також можна використовувати для отримання альдарових кислот. Ця реакція відома з 1880-х років. Однак через низьку ефективність перетворення, несприятливий тепловий ефект реакції та шкідливі побічні продукти (оксиди азоту) цей процес не повністю комерціалізований і вимагає значних промислових удосконалень. Для виробництва цукрової кислоти з глюкози використовуються металеві каталізатори (зазвичай це паладій або платина). Зараз розробляються більш високотехнологічні системи, що містять, наприклад, (2,2,6,6-тетраметилпіперідин-1-іл) кисень (TEMPO) або 4-ацетиламінотемпо, за наявності якого реакція окислення може протікати хемоселективно. Альдарові кислоти також можуть бути синтезовані з відповідних уронових кислот за допомогою золота як каталізатора або електрохімічного окислення.
У хімічному синтезі уронові кислоти утворюються з О-глікозидів та О-фуранозидів. Також можуть використовуватись альдози, але в цьому випадку необхідно захистити вторинні гідроксильні групи, щоб окислити лише первинну групу. Таке окислення здійснюється за допомогою KMnO4 або за наявності метала як каталізатора, такого як платина.
Цукрові кислоти мають широкий спектр можливих застосувань. Альдонові кислоти використовуються в харчовій або сільськогосподарській галузях промисловості (для видалення важких металів із води або ґрунту); у виробництві косметики (як антимікробні засоби) та в пластмасовій промисловості (як силіконові поверхнево-активні речовини). У біомедицині використовуються уронові кислоти як попередники полімерів; альдарові кислоти як інгібітори корозії; речовини, що утворюють поперечні зв'язки, використовуються в гідрогелях; а мономери використовуються у виробництві пластмаси.
Дегідратація цукрів
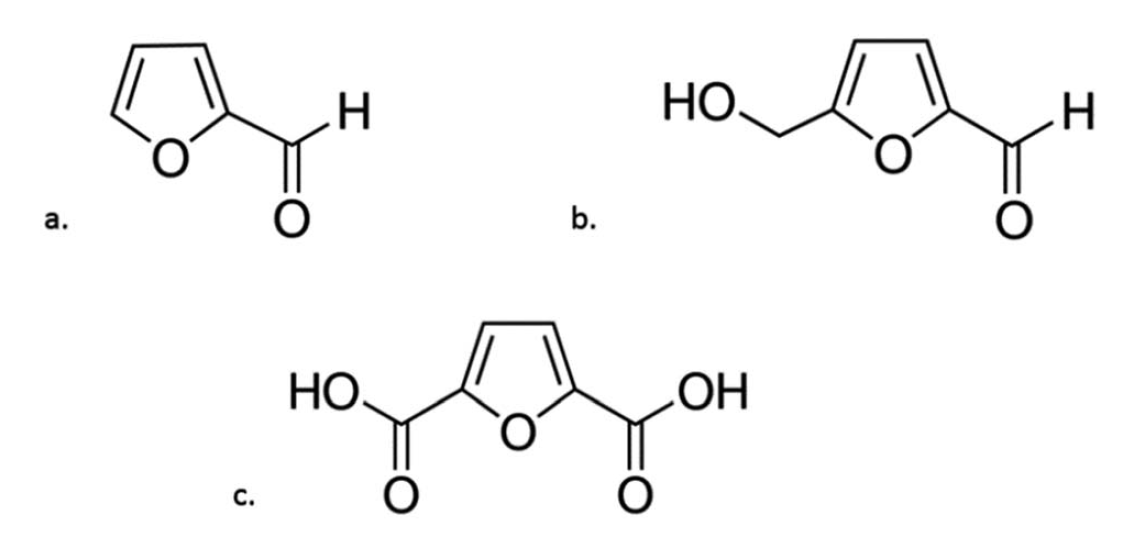
Дегідратація — це ще одна група хімічних реакцій, за допомогою яких можна перетворювати цукри. Процес дегідратації цукру почав розвиватися на початку ХІХ століття. У даний час він широко використовується для синтезу сполук фурану, які можуть поретворюватися в цінні хімічні речовини, включаючи паливо та його компоненти. Найбільш перспективними сполуками цієї групи є фурфурол (F), 5-гідроксиметилфурфурол (HMF) та 2,5-фурандикарбонова кислота (FDCA) (Рис. 5).
Рис. 5. Хімічні формули: (а) фурфуролу; (b) 5-гідроксиметилфурфурол; (c) 2,5-фурандикарбонова кислота
Сьогодні одним із найважливіших продуктів цієї реакції є гідроксиметилфурфурол (HMF), який був предметом сотень досліджень, оскільки це хімічна платформа для отримання багатьох цінних сполук. HMF утворюється в результаті термічного розкладання цукрів, і тому є природною сполукою в меді, каві, соках, вині, хлібові та інших продуктах харчування. Карамелізація є одним із процесів, що викликає його утворення. Ця реакція відбувається за різних умов, залежно від цукру. Наприклад, для фруктози реакція починається при 110°С; для інших гексоз може знадобитися нагрівання суміші до 160°С або вище. Другий тип реакції, що призводить до утворення гідроксиметилфурфуролу (HMF), — це реакція Маяра. Механізм цієї реакції двоступеневий. На першому етапі редукуючий цукор вступає в реакцію з амінокислотою, що призводить до утворення так званої сполуки Амадорі. Другий етап — видалення амінокислоти та утворення 3-деоксиглюкозону (3-DG). Ця сполука має високу реакційну здатність, і її розпад призводить до утворення гідроксиметилфурфуролу (HMF) серед інших сполук. Механізм утворення HMF залежить від типу використовуваного розчинника. Розчинники, такі як диметилсульфоксид (DMSO) та іонні рідини, можуть відігравати активну роль у реакції перетворення цукру в гідроксиметилфурфурол (HMF), змінюючи її механізм. Труднощі виникають головним чином через безрезультатність досліджень проміжних продуктів та широкого спектру побічних продуктів. До побічних продуктів цієї реакції належать органічні кислоти, похідні фурану та полімерні сполуки (включаючи гуміни). Як правило, при тривалій реакції синтезу гідроксиметилфурфуролу вихід HMF зменшується, а левулінова та метанова кислоти утворюються як побічні продукти.
Під час типової кислотної дегідратації цукру гідроксиметилфурфурол (HMF) утворюється переважно з фруктози, як описано в літературних джерелах.
Отримання цієї сполуки з глюкози вимагає ізомеризації глюкози до фруктози, тому що вихід HMF, утворюваного з глюкози, значно нижчий. Ізомеризація глюкози, пов'язана з подальшою дегідратацією фруктози, є досить складним етапом, оскільки перший процес каталізується основою, а другий — кислотою. Для досягнення цього результату використовуються однофазні, двофазні або іонні рідкі системи. Однофазна система є найстарішою і найпопулярнішою. Різна реакційна здатність глюкози, порівняно з фруктозою, та більша селективність фруктози до гідроксиметилфурфуролу (HMF) пояснюються більшою стабільністю кільця фруктози. Більш стабільне кільце фруктози дозволяє утворювати форму проміжного ендіолу, який згодом перетворюється на гідроксиметилфурфурол (HMF).
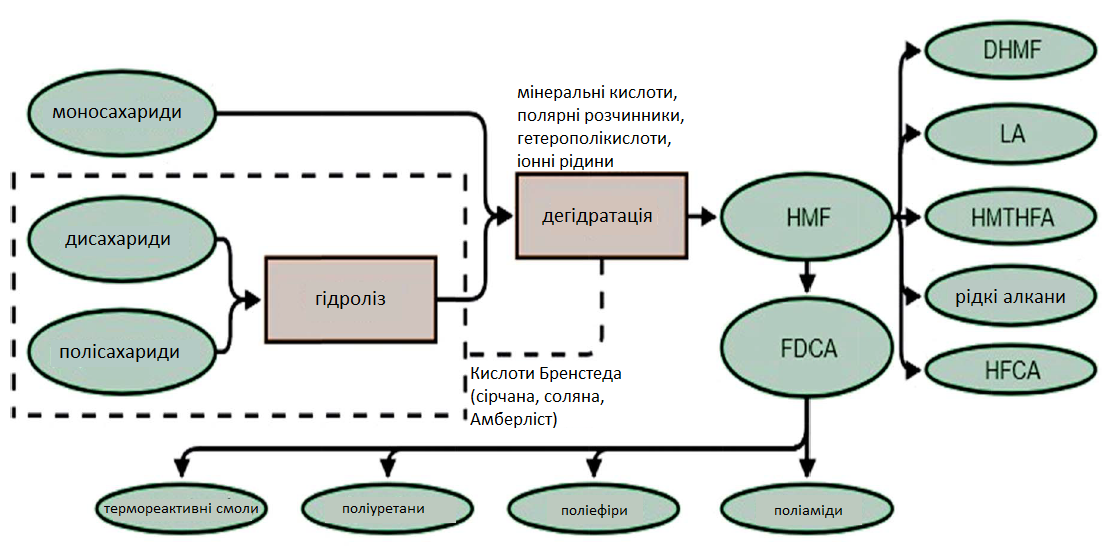
Гідроксиметилфурфурол (HMF) можна отримати не тільки шляхом дегідратації моносахаридів, але також із ди- та полісахаридів. Перший етап — гідроліз полісахаридів. Ця реакція протікає швидше, ніж дегідратація, що дозволяє таким сполукам, як сахароза або інулін, перетворюватися в гідроксиметилфурфурол (HMF) за одноетапну реакцію. Якщо глюкоза є основним цукром в реакційній суміші, перед дегідратацією необхідна її ізомеризація до фруктози. Вихід і селективність гідроксиметилфурфуролу (HMF) при прямому перетворенні цукру досить низькі, а збільшення продуктивності цієї реакції є предметом багатьох наукових досліджень. Отримання гідроксиметлфурфуролу (HMF), цінної хімічної сполуки, із цукрів (а ще краще — з біомаси) може стати дуже економічно ефективним процесом, що дозволить перетворювати відходи у цінні вихідні матеріали, які потім можна використовувати для виробництва полімерів, біопалива або енергії (Рис. 6).
Рис. 6. Синтез та застосування HMF (HMF: 5-гідроксиметилфурфурол; FDCA: 2,5-фурандикарбонова кислота; DHMF: 2,5-дигідроксиметилфуран; LA: левулінова кислота; HMTHFA: 5-гідроксиметилтетрагідрофурфурол; HFCA: 5-гідроксиметилфуранова кислота)
У виробництві гідроксиметилфурфуролу (HMF) з полісахаридів та біомаси використовується безліч різних гомо- чи гетерогенних каталітичних систем. Після процесів гідролізу та дегідратації HMF може одночасно каталізуватися кислотами Бренстеда (наприклад, HCl, H2SO4 та Амберліст (іонообмінні смоли)), тоді як використання кислот Льюїса (наприклад, AlCl3, CrCl3 та Sn-beta) призводить до ізомеризації цукру. Реакції можна проводити у різних розчинниках, включаючи воду та полярні апротонні розчинники (наприклад, диметилсульфоксид, тетрагідрофуран та метилізобутилкетон), які збільшують вихід гідроксиметилфурфуролу (HMF) шляхом постійного виведення продукту з реакційної суміші або обмеженням утворення побічних продуктів. Останнім часом збільшується інтерес до систем, що використовують іонні рідини або гетерополікислоти.
Гідроксиметилфурфурол (HMF) можна перетворити кількома способами, залежно від типу реакції функціональної групи.
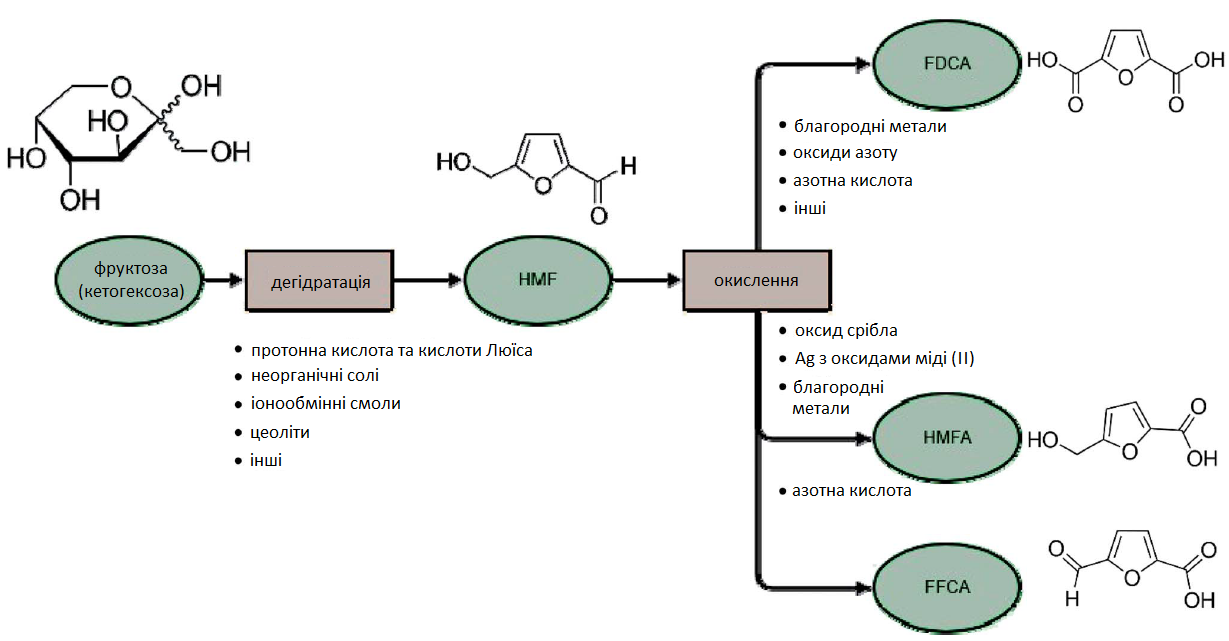
Формільна група може легко окислюватися до карбонової групи: 5-гідроксиметил-2-фуранкарбонову кислоту (також відому як 5-гідроксиметил-2-пірослизова кислота, HMFA) вибірково отримують з гідроксиметилфурфуролу (HMF) без реакції гідроксильної групи.
Другий спосіб — окислення як гідроксильної, так і формільної груп з утворенням 2,5-фурандикарбонової кислоти. Окислення гідроксиметилфурфуролу (HMF) також можливе за допомогою лише гідроксильної групи, яка перетворює HMF у 5-форміл-2-фуранкарбонову кислоту (FFCА). Останні два процеси відбуваються через різну кількість реакцій, поруч один із одним, залежно від умов. У кислому середовищі (водному або у суміші розчинників, таких як диметилсульфоксиду (DMSO) та оцтової кислоти) можна підтримувати карбоксильну групу та стабілізувати формільну групу (Рис. 7).
Рис. 7. Каталітичне окислення гідроксиметилфурфуролу (HMF) в кислоти. HMF: 5-гідроксиметилфурфурол; FDCA: 2,5-фурандикарбонова кислота; FFCA: 5-форміл-2-фуранкарбонову кислоту; HMFA: 5-гідроксиметил-2-пірослизова кислота.
Оскільки гідроксиметилфурфурол (HMF) має величезний виробничий потенціал у хімічній промисловості, дослідники постійно шукають більш ефективні системи для отримання цієї сполуки з цукрів. Більше того, його ринкова ціна в рази вища, ніж матеріалів, із яких він може виготовлятися. У даний час домінуючим фактором, що обмежує прибутковість гідроксиметилфурфуролу (HMF), є вартість чистої фруктози, тому розробляються нові способи отримання HMF з інших сахаридів або відходів промисловості. Якщо у якості вихідної сировини використовувати відходи біомаси, можна отримати субстрат для реакцій без великих фінансових витрат. Однак при оцінці нових систем виробництва гідроксиметилфурфуролу (HMF) слід враховувати потенціал промислового масштабу, а також вихід продукції або ефективність перетворення субстрату.