Боротьба з гниллю цукрових буряків: ефективність штамів Streptomyces проти Fusarium oxysporum

Цукровий буряк (Beta vulgaris var. saccharifera, L.) служить основним і незамінним джерелом цукру для виробництва натуральних підсолоджувачів. Завдяки нижчому споживанню води, порівняно з цукровою тростиною, Єгипет зосереджується на розширенні внутрішнього виробництва цукру, сприяючи вирощуванню цукрових буряків, щоб приборкати дефіцит. Однак цукрові культури стикаються з постійними проблемами з боку різних біотичних патогенів, включаючи гриби, бактерії, віруси та нематоди, що призводить до значного зниження виробництва. Види Fusarium є одними з найнебезпечніших грибів, які викликають кореневі інфекції, які погіршують формування коренеплодів, а також зменшують відсоток цукру та чистоту соку. Ці патогени викликають різні деструктивні захворювання культур, у тому числі фузаріоз, спричинений F. oxysporum f. зр. betae, фузаріозну кореневу гниль, спричинену F. oxysporum f. зр. radicis-betae, фузаріозну гниль стебла, спричинену F. solani, та гниття буряків під час їх зберігання, спричинене F. culmorum, F. cerealis, F. redolens та F. graminearum.
За матеріалами статті на тему «Combatting Sugar Beet Root Rot: Streptomyces Strains’ Efficacy against Fusarium oxysporum» («Боротьба з гниллю цукрових буряків: ефективність штамів Streptomyces проти Fusarium oxysporum») журналу «Plants» («Рослини»), січень 2024 р.
Фузаріозна коренева гниль стає все більш поширеною, особливо в численних районах вирощування цукрових буряків, потенційно в результаті збільшення посівів сприйнятливих сортів. Захворювання проявляється в’яненням листя, міжжилковим хлорозом і зміною кольору судинних тканин кореня, що часто призводить до загибелі рослини. Крім того, збудник утворює велику кількість макроконідій, мікроконідій і хламідоспор, які можуть зберігатися в ґрунті більше 10 років та інфікувати понад 80% сортів цукрових буряків.
Враховуючи потенціал токсичності, різноманітність видів фузаріозу, пов’язаних із цукровим буряком, та економічні збитки, боротьба з цими патогенами є надзвичайно важливою. Незважаючи на те, що хімічні фунгіциди зазвичай використовуються для боротьби з багатьма хворобами рослин, зловживання ними та невибіркове використання призвело до серйозних наслідків для здоров’я людей, тварин і навколишнього середовища. У результаті, їх застосування має бути обмежене. Крім того, кліматичні зміни та поява стійкості до фунгіцидів також знижують ефективність використання синтетичних хімічних речовин.
За останні десятиліття біологічне управління розвинулося як життєздатна, ефективна та безпечна альтернативна технологія боротьби з грибковими фітопатогенами. Новий підхід до боротьби з хворобами та посилення росту рослин передбачає використання бактеріальних і грибкових біоагентів замість синтетичних хімічних речовин. Ізоляційні мікроорганізми, зокрема актинобактерії, виділяються завдяки їх здатності виробляти вторинні метаболіти, такі як антибіотики та позаклітинні ферменти. Цей метод є ефективним у відкритті нових біоактивних метаболітів. Майже 80% антибіотиків отримують з актинобактерій, в основному з родів Streptomyces і Micromonospora. Лише Streptomyces відповідають за приблизно 75% більшості біологічно активних сполук, що включають антибіотики. Здатність цього роду синтезувати антибіотики та різні інші біологічно активні компоненти забезпечує еволюційну перевагу, дозволяючи їм адаптуватися до різноманітних та мінливих стресових умов. Крім того, через складність свого метаболізму вони змогли колонізувати багато екосистем і використовувати широкий спектр джерел вуглецю та азоту.
У тому ж відношенні Actinobacteria, головним чином Streptomyces, виявилися вагомими учасниками, які відіграють важливу роль у боротьбі з ґрунтовими патогенами рослин у ризосферному ґрунті. Вони досягають цього шляхом створення ферментів, які руйнують клітинні стінки грибків, а також виробництва протигрибкових сполук. Крім того, актинобактерії можуть захищати корені рослин від інфекцій і стимулювати розвиток рослин шляхом виділення сполук, що стимулюють ріст рослин, поглинання мінералів і поживних речовин, або прискорюючи розмноження корисних мікробів.
Повідомляється, що способи дії актинобактерій для захисту коренів рослин включають антибіоз, паразитизм, виробництво позаклітинних гідролітичних ферментів, конкуренцію за залізо та індукцію системної резистентності в рослині-хазяїні. Постійні дослідницькі зусилля є життєво важливими для підвищення стійкості до хвороб, дослідження нових засобів біологічного контролю та впровадження стійких методів управління. Застосування цього багатогранного підходу має важливе значення для збереження посівів цукрових буряків і забезпечення стабільного виробництва, незважаючи на проблеми, пов’язані з хворобами, у тому числі з фузаріозом. Дане дослідження мало на меті виділити штами Streptomyces із ризосфери здорових рослин цукрового буряка та оцінити їх потенціал як засобів біоконтролю проти грибкового фітопатогену F. oxysporum, щоб зрозуміти їх взаємодію та потенційний позитивний вплив на цукровий буряк. Ці знахідки є цінними в пошуках нових природних біоагентів, що володіють потужною протигрибковою дією для галузі виробництва цукрових буряків.
Результати
Виділення актинобактерій
Тридцять сім морфологічно різних ізолятів актинобактерій було виділено з ризосфери здорових рослин цукрових буряків. Вісім ізолятів було виявлено у Файюмі, дванадцять у Бені-Суефі, сім у Кафр-еш-Шейхі та десять у губернаторствах Гізи (Єгипет). Усі 37 ізолятів актинобактерій перевірено на їх потенціал антагонізму проти F. oxysporum (F186) in vitro. Результати показали, що 15 із 37 ізолятів показали антагоністичну дію проти цільового патогену (Рис. 1). Серед них два ізоляти актинобактерій, позначені SB3-15 і SB2-23, представляли особливий інтерес через їх потужну антагоністичну активність проти цільового патогену. Вони зафіксували найбільше пригнічення фітопатогену F. Oxysporum, порівняно з іншими виділеними актинобактеріальними ізолятами (Рис. 1). Після подвійного культивування зі штамами SB3-15 і SB2-23 протягом 7 днів при 28°C F. oxysporum F186 продемонстрував вузькі та овальні колонії, порівняно з негативним контрольним зразком (Рис. 2). Середній діаметр росту міцелію F186 досягнув 8,50 см, порівняно з 4,41 см штаму SB3-15 із рівнем інгібування 48,24% і 3,2 см штаму SB2-23 із рівнем інгібування 62,35% (Рис. 1). Тому для подальшого дослідження були обрані два штами.
Рис. 1. Антагоністична активність штамів Streptomyces проти F. oxysporum (F186) in vitro, виміряна як діаметр росту в контрольному зразку та при кожній обробці. Різні малі літери представляють суттєву різницю згідно з тестом множинного діапазону Дункана (p < 0,05).
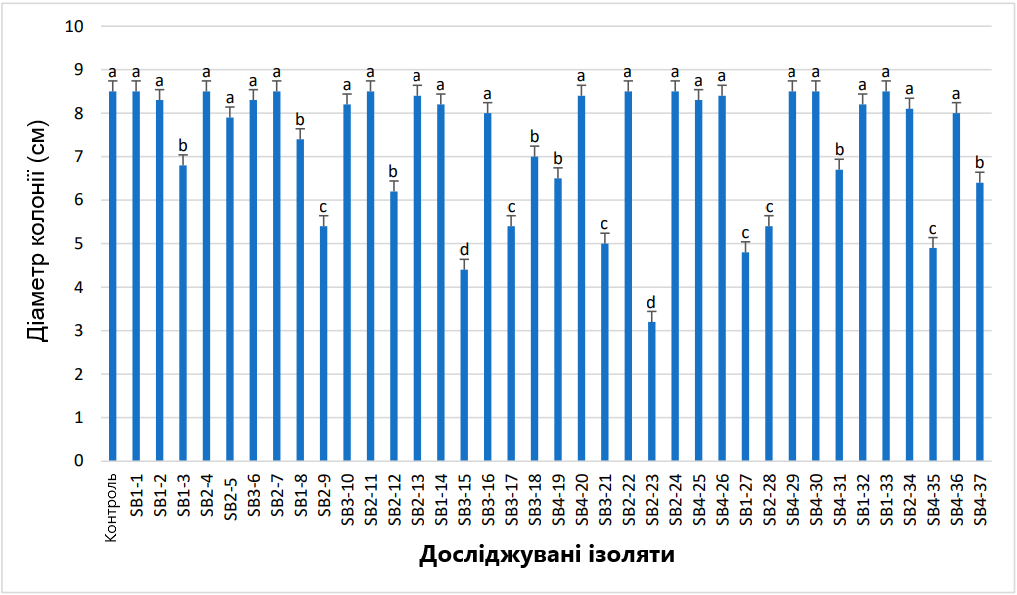
Рис. 2. Антагоністична активність штамів SB3-15 і SB2-23 проти F. oxysporum. (A) F. oxysporum (F186) виріс лише на планшеті PDA через 7 днів після інокуляції. (B) Штам SB3-15, що інгібує ріст міцелію F. oxysporum F186. (C) Штам SB2-23, що інгібує ріст міцелію F. oxysporum F186.
Таксономічна ідентифікація штамів SB3-15 і SB2-23
Дані в Таблиці 1 показують морфологічні та культуральні характеристики конкретних штамів актинобактерій. Штам SB3-15 продемонстрував значний або помірний ріст у всіх використовуваних середовищах ISP. Колір його повітряного міцелію коливався від сірувато-білого до сірого, тоді як колір субстратного міцелію коливався від сірувато-білого до сірувато-коричневого. Розчинних пігментів на використаних середовищах не спостерігалося. Цей штам утворив спорові ланцюги, організовані у вигляді вертицилятів.
Таблиця 1. Морфологічні та культуральні ознаки штамів актинобактерій SB3-15 та SB2-23


Навпаки, штам SB2-23 продемонстрував потужний ріст у всіх дсліджуваних середовищах. Колір його повітряного міцелію змінювався від сірувато-білого до темно-сірого, а колір субстратного міцелію коливався від жовтувато-білого до сірувато-білого. Примітно, що він виробляв жовтий пігмент в ISP1 і ISP2. Крім того, він утворив повітряний міцелій, який характеризується короткими або довгими ланцюжками згорнутих спор.
Ферменти та біохімічні характеристики наведені в Таблиці 2, які показали, що два досліджувані штами актинобактерій можуть продукувати ферменти целюлазу, казеїн, желатиназу, каталазу та хітиназу. Тільки штам SB3-15 може продукувати амілазу; SB2-23 не має такої здатності. Ці ознаки, що спостерігаються, узгоджуються з типовими морфологічними, фізіологічними та біохімічними особливостями, зазвичай пов’язаними зі стрептоміцетоподібними організмами.
Таблиця 2. Біохімічні характеристики штамів актинобактерій SB3-15 та SB2-23

Процес ідентифікації був посилений шляхом проведення філогенетичного аналізу з використанням ПЛР-ампліфікованих та секвенованих послідовностей 16S рРНК із SB3-15, SB2-23 та Streptomyces spp. Цей аналіз підтвердив, що два біологічно активних штами актинобактерій справді належать до роду Streptomyces, як показано на Рис. 3. Філогенетичне дерево, створене за допомогою методу з’єднання, продемонструвало розміщення двох ізолятів у різних кладах у структурі дерева. Примітно, що дерево переконливо свідчить про те, що ізоляти SB3-15 і SB2-23 потенційно означають новий вид у межах роду Streptomyces. Проте для обґрунтування запропонованої класифікації необхідні подальші таксономічні дослідження.
Вплив антагоністичних ізолятів на хвороби цукрових буряків у тепличних умовах
Оцінка захворювання
Ефективність застосування двох штамів Streptomyces SB3-15 та SB2-23 щодо до- та післясходового в’янення та кореневої гнилі сортів цукрових буряків (Toro, Kwamera та Cleopatra), спричинених F. Oxysporum, досліджувалася в тепличних умовах протягом вегетаційного періоду 2021/2022 МР. Дані в Таблиці 3 показують значне зниження захворюваності внаслідок застосування обох штамів Streptomyces, порівнянне з ефектом від застосування хімічного фунгіциду. Зокрема, обробка SB2-23 продемонструвала найвищу ефективність, помітно знизивши середній відсоток захворюваності до появи сходів до 6,67%, порівняно з 44,44%, що спостерігалося в необробленому інфікованому контрольному зразку. Крім того, Streptomyces SB2-23 продемонстрував значну ефективність у зменшенні післясходового в’янення, викликаного F186, досягнувши помітного зниження до 8,89%, перевищивши ефективність інших перевірених методів обробки та інфікованого контрольного зразку, в’янення якого становило 40%.
Таблиця 3. Оцінка активності штамів Streptomyces SB3-15 і SB2-23 щодо контролю до- та післясходового в’янення сортів цукрових буряків, викликаного F. oxysporum F186, в тепличних умовах
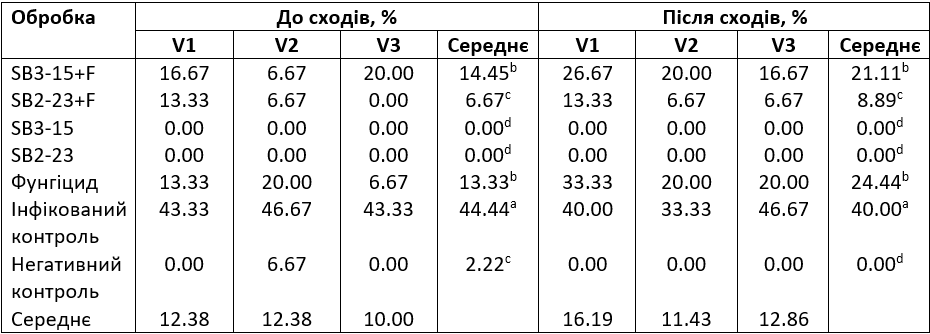
V1: сорт Toro; V2: сорт Kwamera; V3: сорт Cleopatra. SB3-15+F: оброблений штамом Streptomyces SB3-15 та заражений F. oxysporum F186; SB2-23+F: оброблений штамом Streptomyces SB2-23 та заражений F. oxysporum F186; SB3-15: неінфікований, оброблений штамом SB3-15; SB2-23: неінфікований, оброблений штамом SB2-23; фунгіцид: заражені та оброблені промисловим фунгіцидом Металаксил М + флудиксоніл (1 см/кг); інфікований контроль: інфікований F. oxysporum F186 і необроблений зразок; негативний контроль: неінфікований і необроблений контрольний зразок. Середні значення в колонці, за якими йде інша(і) літера(и), суттєво відрізняються відповідно до тесту множинного діапазону Дункана при p ≤ 0,05. Значення є середніми для трьох повторів для кожної обробки, а також для контрольного зразка.
Що стосується важкості кореневої гнилі, спостереження з Таблиці 4 демонструють відсутність симптомів хвороби в неінфікованому контрольному зразку, тоді як усі інфіковані рослини демонстрували типові симптоми фузаріозної кореневої гнилі. Примітно, що інфікований необроблений контрольний зразок продемонстрував найвищий ступінь важкості захворювання, особливо помітний у сорту Kwamera (46,67%), порівняно як з обробленими рослинами, так і з неінфікованим контрольним зразком.
Таблиця 4. Оцінка активності штамів Streptomyces SB3-15 і SB2-23 щодо контролю кореневої гнилі сортів цукрових буряків, спричиненої F. oxysporum F186, в тепличних умовах
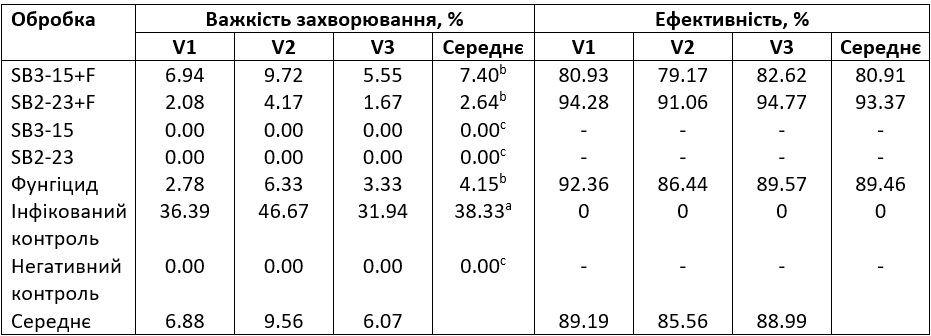
V1: сорт Toro; V2: сорт Kwamera; V3: сорт Cleopatra. (-): немає ефективності. SB3-15+F: оброблений штамом Streptomyces SB3-15 та заражений F. oxysporum F186; SB2-23+F: оброблений штамом Streptomyces SB2-23 та заражений F. oxysporum F186; SB3-15: неінфікований, оброблений штамом SB3-15; SB2-23: неінфікований, оброблений штамом SB2-23; фунгіцид: заражений та оброблений промисловим фунгіцидом Металаксил М + флудиксоніл (1 см/кг); інфікований контроль: інфікований F. oxysporum F186 і необроблений зразок; негативний контроль: неінфікований і необроблений контрольний зразок. Середні значення в колонці, за якими йде інша(і) літера(и), суттєво відрізняються відповідно до тесту множинного діапазону Дункана при p ≤ 0,05. Значення є середніми для трьох повторів для кожної обробки, а також для контрольного зразка.
Обробка цукрових буряків штамами Streptomyces SB3-15 або SB2-23 разом із хімічним фунгіцидом призвели до значного зниження важкості захворювання. Не спостерігалося істотних відмінностей у важкості захворювання серед Streptomyces SB2-23, SB3-15 або фунгіциду.
Цікаво, що Streptomyces SB2-23 продемонстрував найбільш помітне зниження відсотка важкості захворювання (2,64%), демонструючи високий рівень захисту без симптомів захворювання (Рис. 3). Зареєстровано високі показники ефективності 94,28%, 91,06% і 94,77% для сортів Toro, Kwamera та Cleopatra, порівняно з обробкою фунгіцидом (92,36%, 86,44% і 89,57% відповідно).
Рис. 3. Судинні тканини цукрових буряків демонструють вплив ферментаційного бульйону штаму SB2-23 на ріст буряків і їх стійкість до F. oxysporum (ліворуч), а інфікований контрольний зразок демонстрував зміну кольору від сірувато-коричневого до чорного через інфекцію F. oxysporum (праворуч)

Особливості росту та оцінка врожайності цукрових буряків
Висновки, представлені на Рис. 4-7, продемонстрували, що застосування обох штамів Streptomyces, SB3-15 і SB2-23, незалежно від наявності або відсутності патогену, призвело до значного збільшення різних параметрів росту та показників врожайності буряків. Примітно, що спостерігалося значне збільшення свіжої маси коренів, загальної маси рослин цукрового буряку, довжини і діаметра коренеплоду у всіх трьох сортах буряків, порівняно з інфікованим і необробленим контрольними зразками.
Рис. 4. Оцінка впливу штамів Streptomyces на загальну масу цукрових буряків трьох сортів. Негативний контроль: неінфікований і необроблений контрольний зразок; інфікований контроль: інфікований F. oxysporum F186 і необроблений зразок; SB3-15+F: оброблений штамом Streptomyces SB3-15 та заражений F. oxysporum F186; SB2-23+F: оброблений штамом Streptomyces SB2-23 та заражений F. oxysporum F186; SB3-15: неінфікований, оброблений штамом SB3-15; SB2-23: неінфікований, оброблений штамом SB2-23; фунгіцид: заражений F186 і оброблений комерційним фунгіцидом Металаксил М + флудиксоніл (1 см/кг). Дані надані як середнє значення принаймні трьох повторень ± стандартна похибка. Різні маленькі літери (a–d) над смужками позначають значні відмінності згідно з тестом множинного діапазону Дункана при p ≤ 0,05.
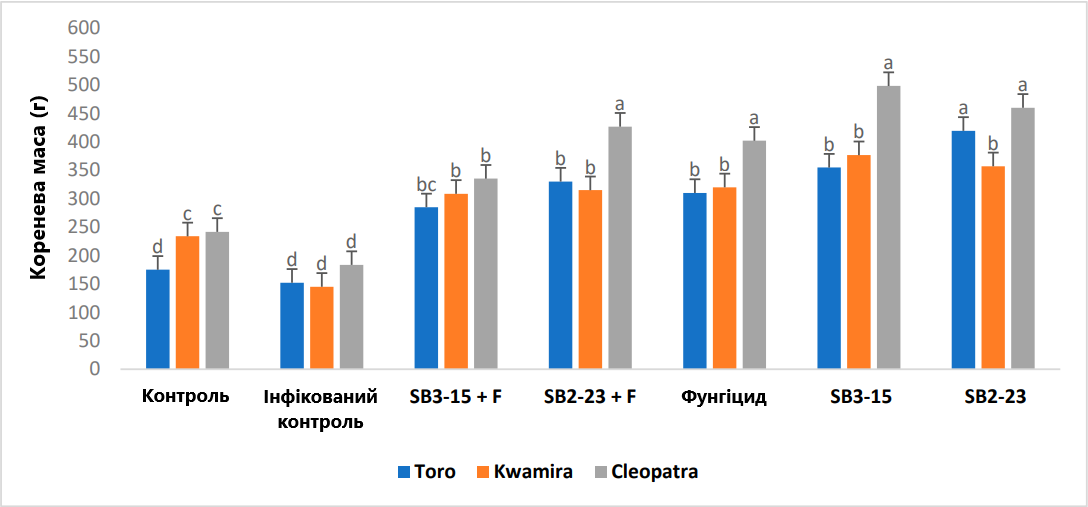
Рис. 5. Оцінка впливу штамів Streptomyces на свіжу кореневу масу сортів цукрових буряків. Негативний контроль: неінфікований і необроблений контрольний зразок; інфікований контроль: інфікований F. oxysporum F186 і необроблений зразок; SB3-15+F: оброблений штамом Streptomyces SB3-15 та заражений F. oxysporum F186; SB2-23+F: оброблений штамом Streptomyces SB2-23 та заражений F. oxysporum F186; SB3-15: неінфікований, оброблений штамом SB3-15; SB2-23: неінфікований, оброблений штамом SB2-23; фунгіцид: заражений F186 та оброблений комерційним фунгіцидом Металаксил М + флудиксоніл (1 см/кг). Дані надаються як середнє значення принаймні трьох повторень ± стандартна похибка. Різні маленькі літери (a–d) над смужками позначають значні відмінності згідно з тестом множинного діапазону Дункана при p ≤ 0,05.
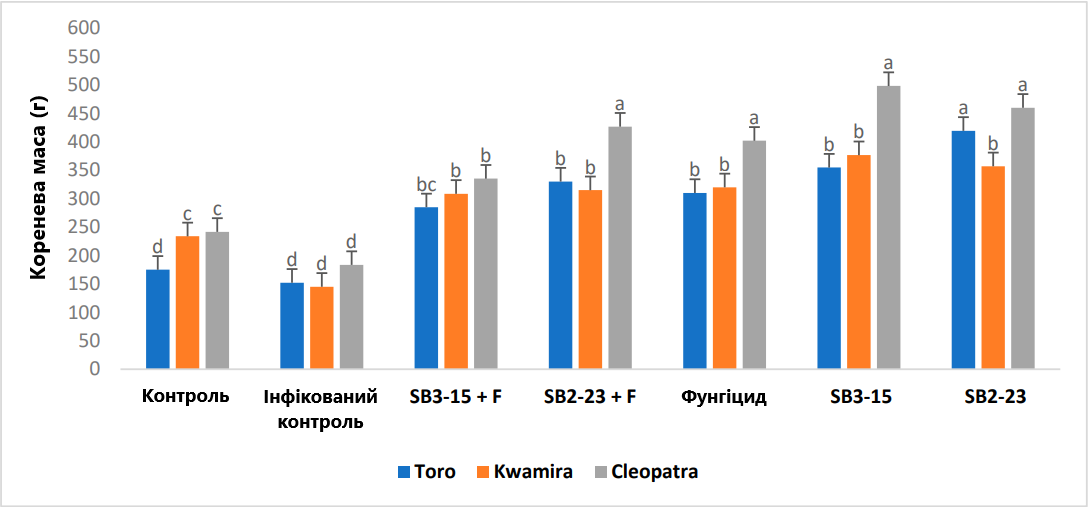
Рис. 6. Оцінка впливу штамів Streptomyces на довжину коренеплоду сортів цукрових буряків. Негативний контроль: неінфікований і необроблений контрольний зразок; інфікований контроль: інфікований F. oxysporum F186 і необроблений зразок; SB3-15+F: оброблений штамом Streptomyces SB3-15 та заражений F. oxysporum F186; SB2-23+F: оброблений штамом Streptomyces SB2-23 та заражений F. oxysporum F186; SB3-15: неінфікований, оброблений штамом SB3-15; SB2-23: неінфікований, оброблений штамом SB2-23; фунгіцид: заражений F186 і оброблений комерційним фунгіцидом Металаксил М + флудиксоніл (1 см/кг). Дані надаються як середнє значення принаймні трьох повторень ± стандартна похибка. Різні маленькі літери (a–c) над смужками позначають значні відмінності згідно з тестом множинного діапазону Дункана при p ≤ 0,05.
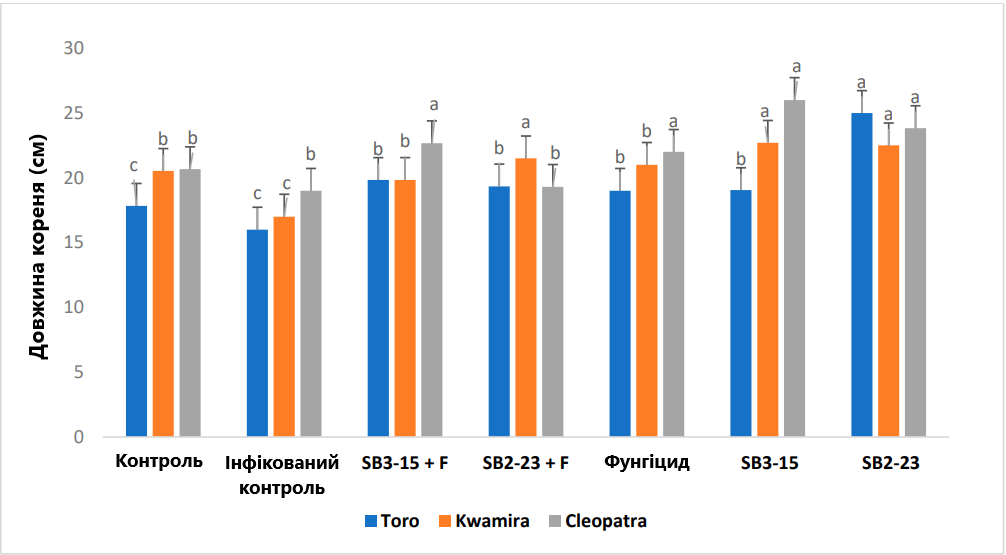
Рис. 7. Оцінка впливу штамів Streptomyces на діаметр коренеплоду сортів цукрових буряків. Негативний контроль: неінфікований і необроблений контрольний зразок; інфікований контроль: заражений F. oxysporum F186 і необроблений зразок; SB3-15+F: оброблений штамом Streptomyces SB3-15 та заражений F. oxysporum F186; SB2-23+F: оброблений штамом Streptomyces SB2-23 та заражений F. oxysporum F186; SB3-15: неінфікований, оброблений штамом SB3-15; SB2-23: неінфікований, оброблений штамом SB2-23; фунгіцид: заражений F186 і оброблений комерційним фунгіцидом Металаксил М + флудиксоніл (1 см/кг). Дані надаються як середнє значення принаймні трьох повторень ± стандартна похибка. Різні маленькі літери (a–c) над смугами позначають значні відмінності згідно з тестом множинного діапазону Дункана при p ≤ 0,05.
Примітно, що фокусуючись на цукрових буряках сорту Cleopatra застосування SB2-23 показало статистично кращі результати за всіма досліджуваними характеристиками росту. Це означає, що SB2-23 мав значно більш виражений позитивний вплив на параметри росту та врожайність, особливо у сорту Cleopatra, перевершуючи як SB3-15, так і контрольні зразки за всіма досліджуваними аспектами.
Ознаки якості цукрових буряків
Відсоток сахарози
Аналіз відсоткового вмісту сахарози, представлений у Таблиці 5, показав вплив різних штамів актинобактерій на вміст сахарози в окремих сортах цукрових буряків. Дані свідчать про значне підвищення відсотка сахарози через присутність штамів актинобактерій SB3-15 і SB2-23. І навпаки, інфікований контрольний зразок мав найнижчі значення сахарози, після якого слідує негативний контрольний зразок. Результати, наведені в Таблиці 5, показали значні варіації у відсотковому вмісті сахарози серед досліджуваних сортів буряків. Зокрема, сорт Toro мав найвищий вміст сахарози, тоді як сорт Cleopatra — найнижчий. Взаємодія між цими факторами помітно вплинула на відсоток сахарози. Примітно, що цукрові буряки сорту Toro, оброблені штамом SB2-23, досягли найвищого відсотка сахарози 17,7%.
Таблиця 5. Вплив взаємодії між обробкою Streptomyces і сортами цукрових буряків на відсоток сахарози та вилученого цукру
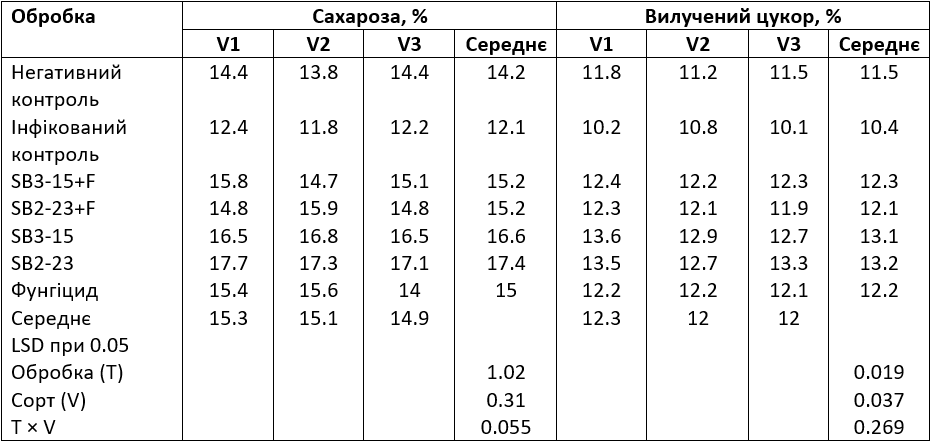
V1: сорт Toro; V2: сорт Kwamera; V3: сорт Cleopatra. Негативний контроль: неінфікований і необроблений контрольний зразок; інфікований контроль: інфікований F. oxysporum F186 і необроблений зразок; SB3-15+F: оброблений штамом Streptomyces SB3-15 та заражений F. oxysporum F186; SB2-23+F: оброблений штамом Streptomyces SB2-23 та заражений F. oxysporum F186; SB3-15: неінфікований, оброблений штамом SB3-15; SB2-23: неінфікований, оброблений штамом SB2-23; фунгіцид + F: інфікований та оброблений комерційним фунгіцидом Металаксил М + флудиксоніл (1 см/кг).
Відсоток вилученого цукру
Дані, наведені в Таблиці 5, показують, що штами Streptomyces демонструють статистичний вплив на відсоток вилученого цукру, відображаючи вплив на відсоток сахарози. Цукровий буряк, оброблений актинобактеріальними штамами, незалежно від зараження фузаріозом, мав значно вищий відсоток вилученого цукру, порівняно як з негативним, так і з інфікованим контрольними зразками. Зокрема, цукровий буряк, оброблений SB2-23, мав найвищий вміст цукру, за яким йшов SB3-15 без суттєвої різниці між ними, але обидва значно перевершували інші види обробок.
Крім того, дані в Таблиці 5 показали значні відмінності між сортами цукрових буряків щодо вмісту цукру, який можна вилучити. Цікаво, що показники вилученого цукру збігалися з сортами з високим відсотком сахарози, причому сорт Тоro мав найвищий вміст цукру.
Взаємодія між обома факторами (обробка штамами актинобактерій і сортами цукрових буряків) суттєво вплинула на відсоток вилученого цукру. Поведінка досліджуваних сортів щодо цієї ознаки була подібною до тієї, що спостерігалася для відсоткового вмісту сахарози при різних обробках. Зокрема, спостерігався значний контраст у відсотковому вмісті вилученого цукру, коли сорти Тоro та Cleopatra оброблялися SB2-23 та SB3-15. Однак не було істотної різниці між ними в їхньому впливі на вилучений цукор.
Домішки та втрати цукру в мелясі
Дані, наведені в Таблиці 6, показали, що домішки в соку, зокрема калій (K), натрій (Na) та альфа-аміноазот, мали незначні відмінності між усіма обробками. Проте спостерігалася значна різниця у втратах цукру в мелясі серед обробок, причому інфікований контрольний зразок продемонстрував найвищі значення цієї ознаки.
Таблиця 6. Вплив взаємодії між обробкою Streptomyces та сортами цукрових буряків на відсотковий вміст K, Na, α-аміноазоту та меляси
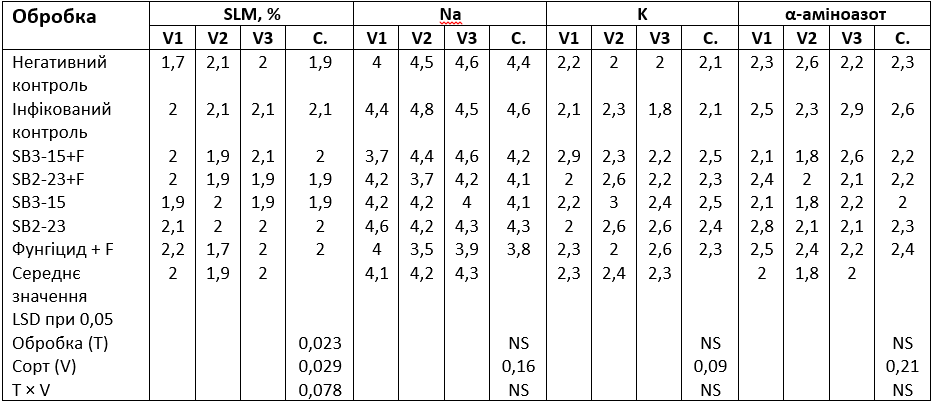
V1: cорт Тоro; V2: cорт Kwamera; V3: cорт Cleopatra; С.: середнє значення. Негативний контроль: неінфікований і необроблений контрольний зразок; інфікований контроль: заражений F. oxysporum F186 і необроблений зразок; SB3-15+F: оброблений штамом Streptomyces SB3-15 та заражений F. oxysporum F186; SB2-23+F: оброблений штамом Streptomyces SB2-23 та заражений F. oxysporum F186; SB3-15: неінфікований, оброблений штамом SB3-15; SB2-23: неінфікований, оброблений штамом SB2-23; фунгіцид + F: інфікований та оброблений комерційним фунгіцидом Металаксил М + флудиксоніл (1 см/кг).
Результати в Таблиці 6 показали, що домішки в соку та втрати цукру в мелясі суттєво відрізнялися між сортами буряків. Було зрозуміло, що сорт Тоro мав найнижчий вміст Na і K (4,1 і 2,3 мг/100 г буряка), тоді як найнижчу втрату цукру в мелясі (1,9 мг/100 г буряка) зафіксував сорт Kwamera. З іншого боку, найвищі значення альфа-аміноазоту були у сортах Тоro та Cleopatra відповідно.
Взаємодія між обома факторами (обробка штамами актинобактерій та сортами цукрових буряків) суттєво впливала на домішки (K, Na та α-аміноазот) та втрати цукру в мелясі.
Обговорення
Фузаріозна коренева гниль, що вражає цукрові буряки, визнана однією з найшкідливіших ґрунтових грибкових хвороб у всьому світі, що значно перешкоджає сталому розвитку цукрової галузі. Широке використання хімічних фунгіцидів призвело до серйозних проблем, пов’язаних зі здоров’ям людей і забрудненням навколишнього середовища. Отже, стратегії біологічного контролю досліджуються як життєздатні та стійкі альтернативи фунгіцидам. Актинобактерії демонструють чудову здатність протидіяти шкідливому впливу, пов’язаному з синтетичними фунгіцидами, а також демонструють позитивний вплив на ріст рослин, що підкреслює їх вирішальну роль у підтримці стійкості екосистеми. Протягом останніх десятиліть Streptomyces з’явилися як «зброя», яка служить захисним механізмом проти фітопатогенних інфекцій і підвищує врожайність культурних рослин. У даному дослідженні з 37 ізолятів актинобактерій, отриманих із ризосферного ґрунту цукрових буряків, 15 виявили значну протигрибкову активність проти досліджуваного фітопатогену F. oxysporum F186. Дане відкриття підкреслює потенційне використання цих ізолятів для боротьби з фітопатогенними захворюваннями. Антагоністична активність актинобактерій проти фітопатогенів може бути досягнута за допомогою різноманітних механізмів, таких як антибіоз, конкуренція поживних речовин, вивільнення деградуючих ферментів, індукована резистентність і виробництво закису азоту. У даному дослідженні оцінювалися антагоністичні ефекти ізольованих актинобактерій через антибіоз, при якому вторинні метаболіти штамів актинобактерій дифундують в агаризованому середовищі, пригнічуючи ріст патогену F. oxysporum. Примітно, що актинобактеріальні штами SB3-15 і SB2-23 продемонстрували найбільш потужне інгібування росту F. oxysporum F186.
Морфологічні та фізіологічні характеристики цих відібраних штамів продемонстрували їх здатність генерувати різні гідролітичні ферменти, такі як целюлазу, амілазу, протеазу, желатиназу, каталазу та хітиназу. Протигрибковий механізм цих штамів може бути пов’язаний з їх здатністю продукувати гідролітичні ферменти. Незважаючи на те, що штам SB2-23 не виявляв активності амілази, він продемонстрував краще інгібування росту F. oxysporum. Цей результат підкреслює значну роль хітинази в поведінці біоконтролю Streptomyces проти збудників кореневої гнилі цукрових буряків. Крім того, ці результати узгоджуються з висновками інших дослідників, які задокументували кореляцію між ефективністю біоконтролю різних видів Streptomyces і виробництвом гідролітичних ферментів, таких як хітинази, протеази та целюлази. Відомо, що ці ферменти руйнують клітинні стінки грибів, що призводить до витоку клітинного вмісту та згодом пригнічує ріст фітопатогенних грибів. Кілька попередніх досліджень також підкреслили потенціал актинобактерій впливати на ріст Fusarium шляхом утворення гідролітичних ферментів. Крім того, Streptomyces володіють здатністю заселяти поверхню коренів рослин, виживати в різних типах ґрунтів і генерувати спори, забезпечуючи їх тривале існування навіть в екстремальних умовах. Штами Streptomyces виявляють широкий спектр антибіотиків і летких органічних сполук, які діють проти патогенів, порушуючи обмін між клітинами грибів. Крім того, вони виробляють низку ферментів, які руйнують клітинні стінки грибів.
Проте здатність штаму пригнічувати захворювання in vitro не обов’язково означає його ефективність як агента біоконтролю in vivo, оскільки штам може не продемонструвати свій потенціал у природних умовах. Таким чином, експерименти в горщиках in vivo проводилися в природних умовах, щоб оцінити ефективність використання штамів Streptomyces SB3-15 і SB2-23 як агентів біоконтролю проти кореневої гнилі, викликаної F. oxysporum. Хвороба в’янення, викликана F. oxysporum F186, перешкоджає проростанню насіння та ранній появі сходів, що призводить до загнивання насіння та молодих сходів. Наші результати продемонстрували, що штами Streptomyces SB3-15 і SB2-23 показали значну ефективність у зменшенні кількості випадків в’янення та підвищення рівня виживання рослин. Крім того, вони зменшили важкість захворювання, порівняно з інфікованим контрольним зразком, безпосередньо впливаючи на патоген і позитивно впливаючи на швидкість проростання насіння. Крім того, ізолят SB2-23 продемонстрував найвищу захисну активність із високою ефективністю в діапазоні від 91,06 до 94,77% порівняно з хімічним фунгіцидом (86,44-92,36%). Кілька Streptomyces spp. та їх біологічно активні речовини, як було продемонстровано, є ефективними засобами біоконтролю проти різноманітних хвороб рослин. Останні дослідження підкреслили антимікробні властивості фенольних сполук, таких як фенол, 2,4-біс(1,1-диметилетил) і фенол, 2,2-метиленбіс[6-(1,1-диметилетил)-4-метил], екстраговані зі штаму Streptomyces H3-2 завдяки їх здатності елімінувати вільні радикали. Крім того, такі сполуки, як алкан (4,6-диметилдодекан) та олефін (бензол, 1,2,3-триметокси-5-(2-пропеніл)-), ідентифіковані у фракціях GC-MS, продемонстрували сильну антимікробну активність, демонструючи потужну ефективність біоконтролю Streptomyces sp. H3-2 проти фузаріозу бананів.
Дане дослідження показало, що застосування двох штамів Streptomyces, SB3-15 і SB2-23, значно посилило численні властивості росту цукрових буряків. Це спостерігалося у збільшенні загальної маси, свіжої маси кореня, діаметра та довжини кореня, порівняно з негативним та інфікованим контрольними зразками. Крім того, ці застосування продемонстрували підвищену стійкість проти фузаріозної кореневої гнилі. Ці висновки узгоджуються з попередніми дослідженнями, які підтверджують гіпотезу про те, що асоційовані з рослинами Streptomycetes дають різноманітні переваги рослинам і збільшують масу коренів та пагонів, довжину коренів цукрових буряків, порівняно з неінокульованими зразками. Однак за всіма оціненими змінними росту сорт Cleopatra, оброблений SB2-23, статистично перевершив два інші сорти. Покращення властивостей росту цукрових буряків, викликане застосуванням SB2-23 та/або SB3-15, може бути пов’язане з важливою функцією цих штамів у контролі кореневої гнилі та прискоренні розвитку рослин.
Крім того, можна відзначити, що чіткий вплив штамів SB3-15 і SB2-23 на відсоток сахарози в сортах буряків певною мірою сприяє росту рослин, оскільки він прискорює проростання насіння для раннього досягнення стадії накопичення цукру. З іншого боку, відсотковий вміст сахарози значно коливався у сортах цукрових буряків. Сорт Тоro досягнув вищого відсоткового вмісту сахарози. А найнижче значення цукру мав сорт Cleopatra. Крім того, цукрові буряки, оброблені SB2-23 за наявності або відсутності зараження ґрунту F. oxysporum F186, мали найкращий вихід цукру, за чим слідує обробка SB2-15 без значної різниці між ними; однак обидва вони статистично перевершили інші методи обробки рослин. Крім того, домішки в соку, тобто K, Na та альфа-аміноазот, а також втрати цукру в мелясі суттєво відрізнялися між сортами цукрових буряків. Сорт Тоro показав найнижчі показники Na і K, тоді як найнижчі втрати цукру в мелясі були зафіксовані у сорту Kwamera. З іншого боку, найвищі значення альфа-аміноазоту були зафіксовані у сортів Toro та Cleopatra відповідно. Сорти можуть відрізнятися за здатністю поглинати поживні речовини, що відображає їх генетичний склад. У цьому контексті попередні дослідження показали помітні відмінності між сортами буряків з точки зору їх якісних характеристик. Застосування Streptomyces SB2-15 і SB2-23 призвело до значного зниження альфа-аміноазоту у всіх сортах, особливо в Kwamera. Це зменшення має вирішальне значення, оскільки підвищені рівні альфа-аміноазоту можуть перешкоджати вилученню цукру. Ці висновки вказують на потенційне майбутнє використання штамів Streptomyces як ефективного засобу біологічного контролю патогенних грибів.
Висновки
Дане дослідження показує ефективність Streptomyces SB3-15 і SB2-23, виділених із ризосфери цукрових буряків, у боротьбі з фузаріозною кореневою гниллю. Штами продемонстрували помітну ефективність у боротьбі з кореневою гниллю та зменшенні її важкості у трьох сортах цукрових буряків (Тоro, Kwamera та Cleopatra). Крім того, штам SB2-23 продемонстрував перевагу, покращивши параметри росту, урожайність, вміст цукру та чистоту в усіх трьох сортах. Ці результати свідчать про те, що використання штаму Streptomyces SB2-23 забезпечує як ефективний біоконтроль проти фузаріозної кореневої гнилі, так і стимулюючий вплив на цукрові буряки, представляючи безпечне та екологічне рішення.